Eficacia de los dentífricos en el tratamiento de la hipersensibilidad dental
Correspondencia:
Carmen Llena Puy
Correo electrónico: llena@uv.es
- Carmen Llena Puy
- Catedrático de Universidad. Departamento de Estomatología. Universitat de València
- Laura Ceballos García
- Catedrático de Universidad. Departamento de Enfermería y Estomatología. Universidad Rey Juan Carlos
- Yolanda Martínez Beneito
- Profesora titular, Departamento de Dermatología, Estomatología, Radiología y Medicina Física. Universidad de Murcia.
- José María Montiel Company
- Profesor Titular. Departamento de Estomatología. Universitat de València.
RESUMEN
Fundamento: La hipersensibilidad dentinaria (HD) afecta a la calidad de vida de las personas y su prevalencia está aumentando por los cambios en los estilos de vida. Esta revisión sistemática (RS) y metaanálisis en red (MAR) analizan la eficacia de diferentes principios activos, presentes en las pastas dentales, para el tratamiento de la HD.
Material y método: Se revisaron ensayos clínicos publicados a partir del año 2000 en cuatro bases de datos. Se evaluó la eficacia de diferentes principios activos presentes en los dentífricos para el tratamiento de la HD. Se incluyeron 95 referencias en la RS y 64 en el MAR.
Resultados: La formulación Pro-Argin©, comparada con un control mostró una mejora significativa de la HD de forma inmediata y a las 4 semanas de uso frente a estimulo evaporativo e inmediato para el táctil (p<0,001). Mediante el análisis SUCRA la formulación Pro-Argin© demostró una probabilidad del 99% y del 92%, respectivamente, de ser el mejor tratamiento inmediata tanto frente a estímulo evaporativo como táctil.
Conclusiones: el mejor efecto inmediato lo proporcionó la tecnología Pro-Argin©, A partir de las cuatro semanas, los productos basados en biocristales, Pro-Argin©, fluorinol y el nitrato potásico combinado con fluoruro de estaño alcanzaron un buen potencial desensibilizante.
Palabras clave: hipersensibilidad dental, pasta dental, revisión sistemática, metaanálisis en red.
ABSTRACT
Background: Dentin hypersensitivity (DH) affects people’s quality of life. Its prevalence increases in relation to changes in lifestyle and eating habits. This systematic review (SR) and network meta-analysis (NMA) analyze the efficacy of different active ingredients, present in toothpastes, for the treatment of HD.
Methods: Clinical trials published from 2000 onwards were reviewed in 4 databases. The efficacy of toothpastes for the treatment of HD was evaluated. Ninety-five references were included in the SR and 64 in the NMA.
Results: The Pro-Argin© formulation, compared with a control, showed a significant improvement of HD immediately and at 4 weeks of use against evaporative and immediate tactile stimulation (p<0.001). By SUCRA analysis, the Pro-Argin© formulation showed a 99% and 92% probability of being the best immediate treatment against both evaporative and tactile stimuli.
Conclusions: the best immediate effect was provided by the Pro-Argin© technology. After 4 weeks, the products based on biocrystals, Pro-Argin© fluorinol and potassium nitrate combined with stannous fluoride achieved a good desensitizing potential.
Key words: dental hypersensitivity, toothpaste, systematic review, network meta-analysis
----
INTRODUCCIÓN
La hipersensibilidad dentinaria o hiperestesia dentinaria (HD) se define como un dolor breve y agudo de la dentina expuesta en respuesta a estímulos térmicos, evaporativos, táctiles, osmóticos o químicos, que no puede relacionarse con otra patología presente en el diente o dientes afectados, y que desaparece al cesar el estímulo1 . Implica una alteración funcional del complejo dentino-pulpar, sin que la pulpa presente cambios inflamatorios o degenerativos. Para que se produzca, la dentina debe estar expuesta y los túbulos dentinarios deben ser permeables2 .
Desde un punto de vista patogénico, se considera que el movimiento del fluido dentinario dentro de los túbulos a partir de estímulos térmicos, mecánicos, evaporativos y osmóticos, provoca deformación de los odontoblastos y sus prolongaciones intratubulares que ocasiona una despolarización de las terminaciones nerviosas de la pulpa, provocando dolor3 . Otra teoría que se ha propuesto para explicar el dolor de la HD, es la presencia de nociceptores pertenecientes a la familia de los Receptores de Potencial Transitorio (TRPs) en la membrana de los odontoblastos y en las fibras nerviosas, capaces de estimularse por el movimiento del fluido dentinario, cambios de presión, temperatura, pH o por mediadores de la inflamación4. Actualmente, la combinación de ambas teorías es la más aceptada, en base a la cual, el movimiento del fluido dentinario estimularía mecánicamente los mecanorreceptores que existen en los odontoblastos y en las fibras nerviosas de la pulpa, por lo que sería la “teoría hidrodinámica del odontoblasto receptor” la que explicaría el mecanismo de la HD. De esta forma estarían implicados tanto los odontoblastos, como las fibras nerviosas y el fluido dentinario. Sin embargo, el mecanismo subyacente todavía no está completamente descrito5,6.
La prevalencia de HD varía según los estudios. Un estudio multicéntrico reciente realizado en siete países de Europa demostró una prevalencia de hipersensibilidad al aire utilizando la escala de Schiff del 75.9%7 . Una revisión sistemática con metaanálisis estableció que la mejor estimación de la prevalencia de la HD fue de aproximadamente el 11.5%, y la media de todos los estudios que se analizaron fue del 33.5%8 . Estas diferencias pueden deberse al modo en que se recoge la información, ya que no es lo mismo la HD reportada por los pacientes, que suele ser mucho menor, que la registrada tras estímulos.
Además, es más prevalente en mujeres, en edades entre los 38-47 años y se espera que se incremente, al estar relacionada con otras patologías como la erosión dental, que está en aumento7 . La HD afecta a la calidad de vida de las personas, produciendo un deterioro significativo en actividades básicas como son hablar, comer, beber o cepillarse los dientes9,10. Es por ello que las escalas de calidad de vida oral, centradas en la influencia que ejerce la HD en la calidad de vida de las personas, cobran cada día un mayor interés para ser aplicadas en estudios clínicos sobre HD. Un ejemplo es el Cuestionario de Experiencia de Hipersensibilidad Dentinaria (DHEQ-15)11, que está diseñado para recoger información no solo acerca del dolor que presenta el paciente, sino también de las restricciones, adaptaciones, limitaciones funcionales, y el impacto social y emocional de la patología que padece. Recientemente ha sido validado en español.
El diagnóstico de la HD se basa en la anamnesis y la exploración clínica. En la anamnesis se tendrán en cuenta los siguientes aspectos: 1) las características del dolor, que se caracteriza por ser corto y agudo; 2) identificación de los estímulos que provocan dolor (térmicos, táctiles, evaporativos, osmóticos, químicos); 3) Determinar el deseo de tratamiento del paciente y, 4) preguntar sobre la presencia de ácidos intrínsecos o extrínsecos2 .La exploración clínica se basa en emplear diferentes métodos de medición de la respuesta dolorosa frente a diferentes estímulos, cuestionarios o una combinación de ambos. Respecto a la respuesta a estímulos, deben de utilizarse al menos dos métodos. Los más utilizados son la respuesta a estímulos táctiles mediante presión controlada (sonda Yeaple), o bien la respuesta al tacto con una presión determinada, generalmente de 40 gr o con la sonda de exploración. La respuesta a estímulos evaporativos medida mediante diferentes escalas es también un método muy común. Las escalas más empleadas son la escala verbal (VRS) de 0 a 3, de 1 a 3 o de 0 a 5 y la escala visual analógica (VAS) de 0 a 10 o de 0-100. La gravedad de la sensibilidad también se ha registrado utilizando escalas ordinales como la escala de dolor de Schiff (0-3)12,13.Además, será necesario realizar un diagnóstico diferencial en el que se descarten: Presencia de lesiones de caries, hipomineralización incisvo-molar (MIH), patología pulpar, fisuras dentales, restauraciones desadaptadas o fracturadas, sensibilidad postoperatoria, enfermedad periodontal, traumatismos recientes, trauma oclusal, tratamiento periodontal o blanqueamiento dental2 .
Para el tratamiento de la HD, además de evitar los estímulos nociceptivos que la provocan, existen dos estrategias: 1) modificar la respuesta nerviosa, alterando o impidiendo la transmisión neuronal, y 2) ocluir los túbulos dentinarios permeables14. Dentro del primer grupo, se incluirían los compuestos a base de potasio (cloruro, nitrato, fluoruro, etcétera), los cuales cambian el potencial eléctrico de las células despolarizadas, reduciendo la excitabilidad nerviosa y, por tanto, la respuesta de las células al estímulo15-18. Para la oclusión de los túbulos dentinarios se han propuesto diferentes principios activos, como los fluoruros, oxalatos, arginina, sales de estroncio, biocristales, glutaraldehído, adhesivos dentinarios o terapia con láser de baja potencia19-24. Estos compuestos están diseñados para su aplicación en clínica y/o su uso en casa, siendo estos últimos, los de uso domiciliario en sus diferentes formas de presentación, pastas dentífricas, geles, colutorios, tiras o chicles con componentes desensibilizantes, los más utilizados para el tratamiento de la HD por su sencillez, menor invasividad y relación coste-beneficio25. Siguiendo las recomendaciones del Canadian Advisory Board2 sobre abordaje terapéutico de la HD, tras un correcto diagnóstico, será necesario eliminar los estímulos nociceptivos que la provocan y comenzar con un tratamiento con productos de uso domiciliario. Si persiste la HD se aplicarán agentes tópicos de uso profesional. Y, en el caso de que no fuera suficiente se incorporarán otras herramientas terapéuticas.
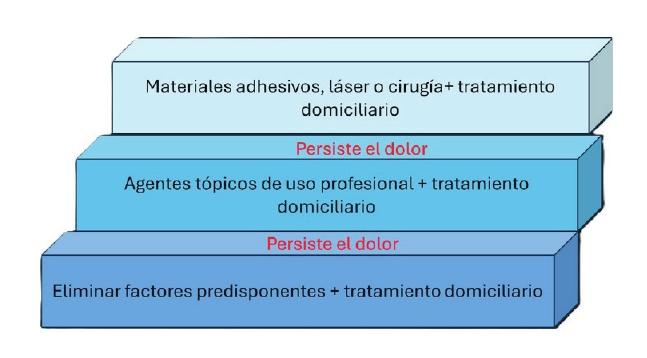
Dado que las pastas dentífricas forman parte de la primera línea de tratamiento y que existe una gran variedad de productos y componentes en su composición, se planteó una revisión sistemática (RS) y un metaanálisis en red (MAR) con el objetivo de analizar la evidencia científica disponible sobre la eficacia de pastas dentífricas desensibilizantes de uso domiciliario con diferentes tiempos de seguimiento frente a estímulos de aire y táctiles.
MATERIAL Y MÉTODOS
Se ha llevado a cabo una RS y MAR siguiendo las directrices PRISMA26. El protocolo para esta revisión sistemática fue registrado en PROSPERO con el número de referencia: CRD42023417460.
Se seleccionaron ensayos clínicos publicados a partir del año 2000, aleatorizados o no, realizados en pacientes mayores de 18 años, que incluyeran al menos dos grupos de comparación y al menos 10 pacientes por grupo, en los que se evaluara el resultado del tratamiento domiciliario de la HD primaria con dentífricos, utilizando al menos dos sistemas de medida de la HD. Se excluyeron estudios en los que la causa de la hipersensibilidad estuviera relacionada con patología dental, tratamiento periodontal previo, o posblanqueamiento dental, que los pacientes estuvieran tomando algún tipo de analgésico o pacientes psiquiátricos.
Se realizó una búsqueda electrónica en mayo de 2023 en cuatro bases de datos seleccionadas, Cochrane CENTRAL Register of Control Trials, Ovid EMBASE, Scopus y Web Of Science (WOS). Se seleccionó una lista de términos de búsqueda utilizando palabras o frases clave, con los operadores boleanos “OR” y “AND”.
Para cada base de datos se adaptó la estructura de la búsqueda.
Una vez realizada la búsqueda se eliminaron los duplicados mediante el software Mendeley y los artículos seleccionados se dividieron en dos grupos de los que se leyeron el título y el resumen por dos parejas de investigadores de forma independiente. Los artículos seleccionados en esta segunda fase fueron de nuevo divididos en dos grupos y los investigadores los evaluaron a texto completo. Se seleccionaron para la extracción de los datos los artículos que cumplían los criterios de inclusión. En caso de discordancia entre la pareja de revisores, los artículos eran revisados por la otra pareja. El nivel de concordancia entre pares de revisores se analizó usando el estadístico Kappa Cohen. La concordancia entre los examinadores JMMC y CLL, así como entre YM y LC se situó entre 0.82 y 0.85, que al ser superior al 0,8 indica un grado de concordancia muy bueno según la escala de Landis y Koch.
Los datos que se recogieron para su análisis fueron: autores, año, país, tamaño muestral, edad media y género, tanto en grupo de estudio como en el grupo control/ es, se incluyeron los nombres comerciales o fórmulas de los productos estudiados, el método de medición de la HD, el resultado obtenido y las conclusiones. Se analizó la efectividad del producto en ensayos clínicos con pacientes con HD tras la aplicación de pastas dentales. Se determinó si existían o no diferencias significativas respecto a los valores basales o al control, así como entre los diferentes grupos de estudio. Siempre que fuera posible, se incluían los datos cuantitativos de cada uno de los resultados del estudio, con la media y la desviación estándar, o el error estándar.
El riesgo de sesgo de los artículos se determinó también por parejas, mediante la escala Cochrane27 para valorar el riesgo de sesgo de los ensayos clínicos aleatorizados (ECAs), analizando el sesgo de selección, el sesgo de realización, el sesgo de detección, el sesgo de desgaste y el sesgo de notificación, mediante la evaluación de 7 dominios. Cada artículo fue analizado para establecer su riesgo de sesgo en cada uno de estos dominios, determinando tres niveles de riesgo: bajo, poco claro o alto.
Para el MAR, se utilizó un método frecuentista usando el paquete Netmeta del software R28 estimando como tamaño de efecto la diferencia de medias estandarizada a partir de las medias y error estándar de las mediciones con las diferentes escalas de hipersensibilidad tras estímulo aire o táctil dos momentos: inmediato y a las cuatro semanas. El tamaño del efecto se estimó comparando cada tratamiento con el placebo o en su defecto con el flúor como tratamiento de referencia, considerando efecto significativo un test zp valor<0.05. La heterogeneidad total del MAR se determinó con el parámetro I2 . La heterogeneidad (dentro de los diseños) fue evaluada mediante la prueba Q, con un nivel de significación nivel de p < 0.05. Para estimar la inconsistencia se calculó como indicador la diferencia entre la estimación directa y la indirecta (SIDE) mediante el método back-calculation method combinado con el modelo de efectos aleatorios para valorar la existencia de desacuerdo entre ambas estimaciones (test zp valor<0.05). La superficie bajo la curva de clasificación acumulativa (SUCRA) es la clasificación del tratamiento dentro del rango de tratamientos, medida en una escala de 0 (peor) a 1 (mejor)29. Se utilizó un método de remuestreo basado en 1000 simulaciones para calcular los SUCRA.
RESULTADOS
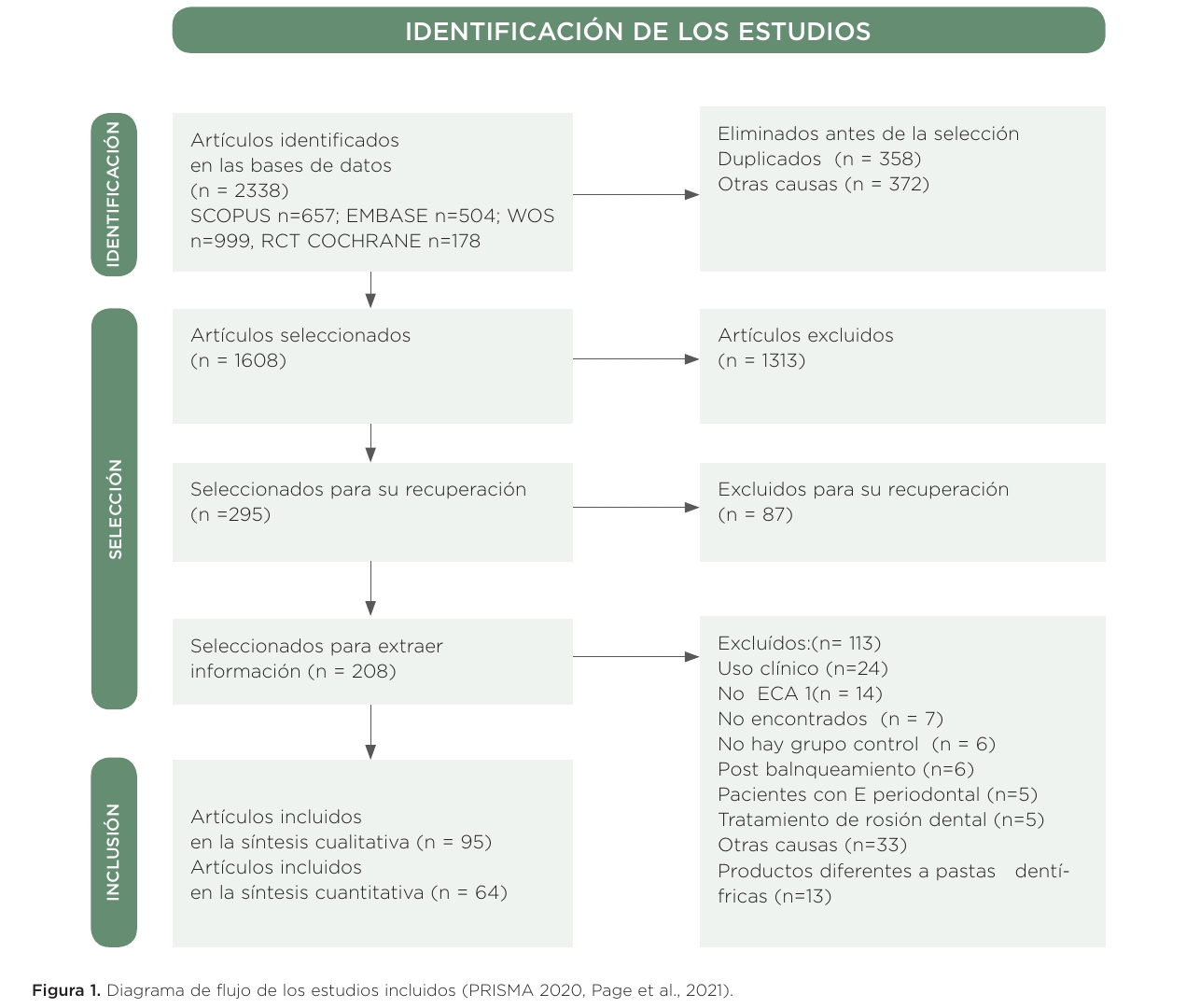
Tras la búsqueda en las bases de datos RCT Cochrane, Scopus, EMBASE y WOS, (n=2.338) y tras eliminar los duplicados (n=730), se seleccionaron 1.608 referencias que fueron potencialmente relevantes. Tras la lectura del título y del resumen, y tras aplicar los criterios de inclusión y exclusión, quedaron un total de 208 artículos para su lectura a texto completo. De estos, quedaron excluidos por diferentes motivos que se detallan un total de 113 artículos, por lo que quedaron definitivamente incluidos para el análisis cualitativo 95 referencias en las que se evaluaban pastas dentífricas y para la síntesis cuantitativa 64 (Figura 1).
El análisis del riesgo de sesgo intra-estudio evaluado mediante la herramienta Cochrane, puso de manifiesto que, del total de 95 artículos incluidos, aproximadamente un 32% (30 artículos) tenían un riesgo de sesgo alto en alguno de los factores analizados, únicamente se han detectado 10 artículos (10,52 %) en el que ninguno de los factores presentara sesgo, los 55 restantes, presentaban sesgo poco claro en alguno de los ítems analizados. Cabe destacar que 55 artículos habían sido financiados o realizados por empresas del sector dental, lo que se anotó como sesgo poco claro en el apartado “other bias”.
CARACTERÍSTICAS DE LOS ESTUDIOS
La mayor parte de los estudios, 52 de 95, se realizaron en países asiáticos, fundamentalmente en India26 y China19. En Europa se llevaron a cabo el 27.4% (26 de 95), y la mitad de ellos en Reino Unido. Por último, 14 estudios se realizaron en América del Norte y 2 en Brasil, y un trabajo fue una colaboración entre Italia y EE.UU., otro entre EE.UU., Puerto Rico y la República Dominicana. Por último, en otro no se indicaba el lugar de realización.
En cuanto al tamaño muestral, era muy variable, oscilando entre el trabajo de Acharya et al., (2013)30. en el que evaluaron 20 pacientes y el de Langrial et al., (2022)31, cuya muestra incluía 459 individuos.
PRODUCTOS ESTUDIADOS Y SU EFECTO EN LA HD ANALIZADOS MEDIANTE LA SÍNTESIS CUALITATIVA
Contienen la tecnología Pro-Argin©
La arginina al 8% con carbonato cálcico y 1450 ppm de monofluorofosfato sódico (MFP), denominada tecnología Pro-Argin©, se ha evaluado en 26 estudios15,23,31-52.En los estudios de Hegde et al., (2013), Kakar et al., (2012a) y Kakar et al., (2013) hallaron una reducción de la sensibilidad mayor con Pro-Argin© a las 2 y 8 semanas frente a una pasta dental fluorada de 1000 ppm de MFP43,44,46. En el estudio de Li et al., (2011), se redujo la sensibilidad tras una aplicación por fricción en la consulta y a los siete días de uso en casa respecto al control (pasta fluorada 1100 ppm) y respecto a una pasta de acetato de estroncio al 8% + 1400 ppm de flúor47. En el estudio de Natho et al., (2009), resultó más eficaz que el nitrato potásico al 5%+ 1450 ppm de flúor y que una pasta con solo 1450 ppm de FNa, tanto inmediatamente tras su aplicación como a los tres días15. Boneta et al., (2013a) reportaron resultados similares tanto frente a estímulos táctiles como de aire a las 2, 4 y 8 semanas, pero más rápidos con la formulación Pro-Argin© 35 Por su parte, Franca et al., (2015) hallaron un efecto final similar a las 8 semanas, pero más rápido a las 4 semanas, con a pasta con la tecnología Pro-Argin© que con nitrato potásico al 2%+1000 ppm de FNa39. Kar et al., (2019) describieron una mayor eficacia con una pasta con la tecnología Pro-Argin© que con una pasta a base de sales de potasio (Sensodyne) y una fórmula herbal no comercial43. Kakar et al., (2012b) también determinaron que la eficacia con una pasta que contenía Pro-Argin© era más eficaz que una pasta de nitrato potásico al 2% + 1000 ppm de FNa desde las primeras dos semanas de su empleo hasta ocho semanas de estudio45. Sin embargo, en los estudios de He et al., (2011a), hallaron un efecto desensibilizante mayor con una pasta de fluoruro de estaño al 0.454% que con la tecnología Pro-Argin© a los 3 y 15 días de tratamiento42. Por otro lado, Orsini et al., (2013) describieron un efecto similar a los tres días utilizando la pasta con Pro-Argin© , que la que incluía acetato de estroncio al 8% y flúor y otra con nanocristales de hidroxiapatita23.
En el mismo sentido apuntan los estudios de Anand et al., (2017), tras cuatro semanas de uso al comparar la tecnología Pro-Argin© con una pasta que contenía nanohidroxiapatita32. Patel et al., (2019) describieron una reducción de la sensibilidad al mes superior con CSP-F (Biomin©) respecto a Pro-Argin© y superior de Pro-Argin© respecto al control, a los 15 días y al mes de su aplicación48. Arshad et al., (2021) reportaron un efecto inmediato y a la semana mejor con la incorporación de Pro-Argin© y con acetato de estroncio al 8% +FNa que con Biomin©- , mientras que a las 8 semanas Pro-Argin© y Biomin© se igualaron en el efecto33. En el estudio de Que et al., (2010), se evaluaron dos pastas que incorporaban la tecnología Pro-Argin© , una de las cuales contenía un sistema basado en carbonato de alta limpieza, y ambas fueron más eficaces que una pasta sin Pro-Argin© y con flúor y carbonato cálcico tras una aplicación inicial en la consulta y hasta las ocho semanas de seguimiento49. En el estudio de Samuel et al., (2015), se halló mayor efectividad frente a estímulos táctiles, aire y frío con la pasta que contenía Pro-Argin© que con la que incorporaba fosfosilicato de calcio y sodio —CSPS— al 5% (Novamin©) junto con 1450 ppm de MFP, inmediatamente tras su aplicación y tras un mes de tratamiento50. Sin embargo, Hall et al., (2017) reportaron un efecto similar en la reducción de la sensibilidad al comparar pastas de las mismas características, a las 2, 4, 6 y 11 semanas41 Fu et al., (2019) describieron resultados similares al comparar una pasta de Pro-Argin© con una al 2.5% de CSPS +1426 ppm de FNa40. En el mismo sentido Devi Bala et al., (2019) reportaron un resultado similar al comparar una pasta con Pro-Argin© y otra con biocristales tras cuatro semanas de tratamiento36. Schiff et al., (2011) a los tres meses de tratamiento encontraron una mayor eficacia con una pasta de Pro-Argin© que con una de acetato de estroncio al 8% y 1040 ppm de FNa51. Resultados similares se hallaron en el estudio de Docimo et al., (2011) a 2, 4 y 8 semanas frente a estímulos táctiles y al aire38. Langrial et al., (2022) también reportaron efectos similares con la pasta de Pro-Argin© y con una pasta de acetato de estroncio, similar a la anterior, tras ocho semanas de tratamiento31. Sin embargo, Huges et al., (2010), encontraron un mayor efecto a las cuatro semanas con una pasta de las mismas características de acetato de estroncio y a las ocho semanas con la pasta de Pro-Argin© 44 . Ayad et al., (2009) la compararon con una pasta de cloruro de potasio al 2% y 1450 ppm de FNa, hallando mayor efectividad con la que contenía Pro-Argin© tanto al evaluar la sensibilidad táctil como al aire34. Docimo et al., (2009) hallaron resultados similares a las 2, 4 y 8 semanas37. Por último, Schlee et al., (2017) compararon una pasta a base de una matriz de péptidos autoensamblados (SAPM) frente a otra incorporando la tecnología Pro-Argin© , hallando resultados similares a los 3, 6, 30 y 90 días de tratamiento52.
Contienen acetato o cloruro de estroncio
La efectividad del acetato de estroncio al 8% junto con 1040 ppm de FNa (Sensodyne Rapid Relief) se ha estudiado en ocho artículos31,33,40,44,47,51,53,54. En el estudio de Li et al., (2011) resultó menos eficaz que una pasta con la tecnología Pro-Argin© y similar al control con una pasta fluorada de 1100 ppm, tanto tras una aplicación como a los siete días47. Arshad et al., (2021) hallaron un efecto inmediato y a la semana mejor con Pro-Argin© o con acetato de estroncio al 8% y FNa que con Biomin© mientras que a largo plazo el Biomin© y la pasta de Pro-Argin© resultaron más eficaces33. Docimo et al., 2011 compararon el acetato de estroncio con una pasta que contenía la tecnología Pro-Argin© , hallando mayor eficacia con esta última a las 2, 4 y 8 semanas tanto al tacto como al aire38.
Resultados similares reportó Schiff et al., (2011) a los tres meses de tratamiento resultando más eficaz una pasta de Pro-Argin© que una de acetato de estroncio52 mientras que Huges et al., (2010), hallaron mayor efecto a las cuatro semanas con una pasta de acetato de estroncio y a las ocho semanas con la pasta de Pro-Argin©44. Sin embargo, en el estudio de Orsini et al., (2013) encontraron un efecto similar de la pasta con acetato de estroncio a los tres días, la que incluía Pro-Argin© y otra con nanohidroxiapatita y zinc23. En el estudio de Mason et al., (2010), resultó más eficaz el acetato de estroncio, inmediatamente y a los tres días que una pasta de 1450 ppm de flúor53.
Resultados similares hallaron Zang et al., (2016), al compararla con una pasta de 1400 ppm de MFP a las 4 y 8 semanas para la sensibilidad al aire54. El cloruro de estroncio al 10% se ha evaluado en seis artículos17,55-59.Majji et al., (2016) utilizaron una pasta con cloruro de estroncio al 10% y la compararon con otra que incluía nitrato potásico al 5%, otra con Novamin©© y una cuarta con una formulación herbal, hallando mejores resultados a las dos semanas, uno y dos meses con la pasta que incorporaba Novamin©©, aunque en todos los grupos hubo mejora respecto a los valores basales17. Du et al., (2008) compararon pastas que incluían cloruro de estroncio frente a otra con Novamin©© y un placebo, resultando en una reducción de la sensibilidad a las dos semanas, pero no a las seis, mientras que Novamin©©, redujo más la sensibilidad en todos los momentos del estudio57. Aggarwal et al., (2019) compararon una pasta con cloruro de estroncio con otra con Biomin© y otra con Novamin©, hallando un efecto similar con los tres productos55. Una formulación con cloruro de estroncio al 10% junto con oxalato potásico al 5% y FNa al 5%, estudiada por Antoniazzi et al., (2014), produjo una mayor reducción de la sensibilidad a los 7, 15 y 30 días que con una pasta de FNa al 2% o un placebo56. Jang et al., (2023) compararon una pasta con cloruro de estroncio con una pasta de trifosfato cálcico al 19%, no hallando diferencias entre ambas a la semana ni a las cuatro semanas de tratamiento ni frente a estímulos de aire, frío o ácidos58. Por último, Lee, et al., (2015) compararon una pasta con el cloruro de estroncio frente a una pasta con nanohidroxiapatita al 20% y 8% de sílice, no hallando diferencias entre ambas a las cuatro semanas de tratamiento59.
Nitrato, cloruro, citrato y oxalato potásico
El nitrato potásico al 5% junto con 1450 ppm de FNa se ha evaluado en 24 estudios18,20,30,35,45,51,60-76.En el estudio de Natho et al., 2009, se comparó el nitrato potásico al 5% y 1450 ppm de FNa, con una pasta que contenía 1450 ppm de FNa y otra con la tecnología Pro-Argin© hallándose que esta última pasta producía una reducción de la sensibilidad mayor, inmediatamente y a los tres días, que las otras dos pastas, sin diferencias entre ellas63. Evaluando los mismos productos, Boneta et al., (2013a) encontraron que, a pesar de que en los grupos hubo reducción de la sensibilidad, fue más rápida con la pasta de Pro-Argin© , a las 2, 4 y 8 semanas, tanto frente a estímulos táctiles como al aire35. Estos resultados coinciden con los de Franca et al., (2015), frente a estímulos de aire. Kar et al., (2019) reportaron una mayor eficacia con una pasta de Pro-Argin© que con una pasta a base de sales de nitrato de potasio (Sensodyne) y una fórmula herbal no comercial39. En el estudio de Kakar et al., (2012b), en este caso con una pasta de nitrato potásico al 2%, también resultó menos eficaz que la tecnología Pro-Argin©© a las 2, 4 y 8 semanas45. WaraAswapati et al., (2004) compararon una fórmula con nitrato potásico, triclosán y MFP con otra sin triclosán y con otra sólo con MFP, y reportaron resultados similares con las dos formulaciones que contenían nitrato potásico76. En el estudio de Acharya et al., (2014), tras dos semanas de uso, resultó ser más eficaz una pasta con Novamin© al 5%, mientras que a las 4 y 8 semanas no se hallaron diferencias entre la pasta con nitrato potásico al 5% o la de Novamin© 30. Sin embargo, en el estudio de Narongdej et al., (2010), resultó ser menos eficaz que una pasta de CSPS al 7.5 % aplicado por fricción en la consulta y en casa durante una, dos y cuatro semanas65. En los estudios de Pradeep et al., (2010 y 2012), el nitrato potásico al 5% se comportó peor que Novamin© a las 2 y 6 semanas y de forma similar al fluoruro de aminas a las seis semanas. Majji et al., (2016), compararon nitrato potásico al 5%, con una pasta con Novamin© y con una formulación herbal, hallando mejores resultados a las dos semanas, uno y dos meses con la pasta de Novamin© respecto a las otras dos66,67. En el mismo sentido, Salían et al., (2010) hallaron resultados significativamente mejores con Novamin© respecto al control o al nitrato potásico tras 2 y 4 semanas de tratamiento, mientras que el nitrato potásico fue más eficaz que el control a la cuarta semana69. En la misma línea se expresan los resultados de Surve et al., (2011), a las ocho semanas de tratamiento75. Sharma et al., (2010), compararon una pasta con nitrato potásico con otra con Novamin© y otra con fluoruro de estaño, y las tres pastas redujeron la sensibilidad, pero fue más eficaz la que contenía Novamin© 71. Orsini et al., (2010) compararon una pasta con nitrato potásico con una fórmula que contenía nanocristales de hidroxiapatita y zinc, hallando una mejora de la sensibilidad con ambos productos, aunque significativamente mejor en el grupo de los nanocristales de hidroxiapatita a las 4 y 8 semanas20. En el estudio de Gallob et al., (2017), se comparó una pasta de nitrato potásico con una de 1150 ppm de fluoruro de estaño y con un control con 1150 de FNa, las dos pastas del grupo experimental se comportaron de forma similar y mejor que el control a las 4 y 8 semanas60. En el estudio de Ni et al., (2010), la pasta con nitrato potásico se comportó de forma similar a la que contenía cloruro de estaño y 1450 ppm de FNa, en cuanto a la reducción de la hipersensibilidad al tacto64. En el trabajo de Schiff et al., (2000), la asociación de nitrato potásico al 5% junto con fluoruro de estaño al 0.454% resultó ser más eficaz que la formulación de nitrato potásico al 5% y MFP al 5% a las 2,4 y 8 semanas de tratamiento51. En la misma línea apuntan los resultados obtenidos por Sowinski et al., (2000a)72.
Sowinski et al., (200b) compararon una fórmula con nitrato potásico al 5%, fluoruro de estaño al 0.454% y 1450 ppm de FNa, que resultó ser más eficaz que una pasta control con 1450 ppm de FNa73. Sowinski, et al., (2001), compararon una fórmula experimental como la anterior con un control a base de cloruro potásico, FNa y triclosán, hallando mejores resultados con la fórmula experimental74. Parkinson et al., (2017) evaluaron una formulación de nitrato potásico al 5% con 3% de copolímero (O/MA) y la compararon con otra sin copolímero y con un control de 1000 ppm de FNa, hallando una cierta mejora con la incorporación del copolímero cuando se evaluó la sensibilidad táctil a las cuatro y ocho semanas18. Pretha et al., (2006) en su estudio hallaron reducción similar de la hipersensibilidad a las seis y diez semanas con una pasta de nitrato potásico solo o combinado con EMS, (una sal alcalina que contiene NaCl, Na2 SO4 , NaHCO, K2 SO4 )68. Seong et al., (2021) compararon una formulación con nitrato potásico, lactato de aluminio, hidroxiapatita y MFP con nitrato de potasio y FNa, hallando mejora de la sensibilidad significativa con la primera combinación de componentes70. Una pasta con nitrato potásico al 5% y citrato de zinc al 0.5% proporcionó una reducción de la sensibilidad mayor que un control a base de FNa al 0.24%, según el estudio de Katanec et al., (2018)61. Kumari et al., (2016) compararon una combinación de nitrato potásico al 5% con y sin una fórmula herbal (oloaracia spinacia), no hallando diferencias en la reducción de la sensibilidad entre ambas pastas62.
El cloruro potásico al 3.75% y 1450 ppm FNa ha sido evaluado en cinco estudios34,37,77-79. Ayad et al., (2009) compararon una pasta de cloruro de potasio al 3.75% y 1450 ppm de FNa con una con la tecnología Pro-Argin©, hallando mayor efectividad con esta última, tanto frente a la sensibilidad táctil como al aire34. En el mismo sentido apuntan los resultados obtenidos por Docimo et al., en sus estudios de 2007 y 200937,77. Hu et al., (2004), compararon una pasta de cloruro potásico con una de citrato potásico, no hallando diferencias entre ambas a las dos, cuatro y ocho semanas78. Young et al., (2017) compararon una pasta de cloruro potásico con 1450 ppm de FNa, hallando mayor reducción de la sensibilidad al aire a las dos, cuatro y ocho semanas con la de cloruro potásico79.
El citrato potásico al 5.5% junto con MFP al 1.14% ha sido evaluado en tres estudios78,80,81.El empleo de una pasta que contenía un 5.5% de citrato potásico junto con MFP al 1.14% y HCS al 10% en una base de sílice utilizada durante un periodo de ocho semanas produjo una reducción de la sensibilidad, sin diferencias con el control positivo a base de cloruro de potasio al 3.75%, FNa al 0.32% y triclosán al 0.3% en base de sílice (Hu et al., 2004)78. Pradep et al., (2010) compararon una formulación similar a la anterior de citrato de potasio con FNa al 0.3%, triclosán y copolímero al 2%, hallando con ambas formulaciones una reducción de la sensibilidad respecto a los valores basales, pero sin diferencias entre ambos66. Por último, Yates et al., (2015) compararon una pasta de citrato potásico y 1450 ppm de FNa con otra idéntica a la que además incorporaron triclosán y citrato de zinc y ambas tuvieron un efecto similar en la reducción de la sensibilidad81.
El oxalato potásico ha sido evaluado en un estudio, Antoniazzi et al., (2014), en el cual una formulación con cloruro de estroncio al 10%, oxalato potásico al 5% y FNa al 5% produjo una mayor reducción de la sensibilidad a los 7, 15 y 30 días que una pasta de FNa al 2% o un placebo56.
Fosfosilicato de calcio y sodio fosfosilicato (CSPS), Novamin©, Biomin©, nanohidroxiapatita y trifosfato cálcico
La eficacia de Novamin© u otras formulaciones de CSPS se ha evaluado en 15 estudios17,19,40,41,50,55,57,65,66,67,69,71,82-84. En el estudio de Rajesh et al., (2012), se halló mejora a las seis y ocho semanas respecto a un control82. Aggarwal et al., (2019), en su ensayo compararon Novamin© con Biomin© y con cloruro de estroncio, resultando los tres productos efectivos en la reducción de la sensibilidad de forma similar55. Du et al., (2008) compararon el cloruro de estroncio frente a Novamin© y un placebo produciendo todos ellos una reducción de la sensibilidad a las dos semanas; sin embargo, el cloruro de estroncio no fue eficaz a las seis semanas y Novamin© redujo más la sensibilidad en todos los tiempos de evaluación del estudio en comparación con los otros dos grupos57. En el estudio de Litkowski et al., (2010), el CSPS al 7.5% resultó más eficaz que el CSPS al 2.5 % y que el control a base de MFP a las ocho semanas19. Majji et al., (2016) utilizaron cloruro de estroncio al 10% y lo compararon con nitrato potásico al 5%, con pasta con Novamin© y con una formulación herbal, hallando mejores resultados a las dos semanas, uno y dos meses con la pasta de Novamin©, aunque en todos los grupos hubo mejora respecto a los valores basales17. En el estudio de Narongdej et al., (2010), el CSPS al 7.5%, resultó más eficaz que el nitrato potásico al 5% junto con 1000 ppm de FNa aplicado por fricción en la consulta y en casa durante una, dos y cuatro semanas65. Salian et al., (2010) reportaron resultados significativamente mejores con Novamin© respecto al control o al nitrato potásico tras os y cuatro semanas de tratamiento69. En los estudios de Pradeep et al., publicados en 2010 y 2012, el nitrato potásico al 5% se comportó peor que Novamin© a las dos y seis semanas y de forma similar al fluoruro de aminas a las seis semanas66,67. Samuel et al., (2015) compararon una sola aplicación en la consulta de Novamin© con una pasta con la tecnología Pro-Argin©, hallando una mayor reducción de sensibilidad al aire, al frío y a la presión con esta última, así como más duradera en el tiempo (30 días)50. Fu et al., (2019) hallaron resultados similares al comparar una pasta con Pro-Argin© con una con CSPS al 2.5% y 1426 ppm de FNa durante tres días84. Hall et al., (2017) compararon una pasta de Novamin© y 1450 ppm de MFP, con una pasta con Pro-Argin© y con un control con 1400 ppm de MFP, no hallando diferencias entre las dos pastas a estudio entre una y 11 semanas de tratamiento41. Sharma et al., (2010) compararon una pasta de nitrato potásico al 5%, otra de fluoruro de estaño al 0.4% y otra de CSPS al 7.5% y todas resultaron eficaces a las dos, cuatro y 12 semanas, pero la que contenía CSPS consiguió una reducción de la sensibilidad al aíre y al frío superior a las dos semanas de tratamiento71. Por último, Sufi et al., (2016) compararon una pasta con Novamin© y 1500 ppm de MFP con un placebo que contenía abrasivo y 1500 ppm de MFP, otra pasta con 1000 ppm de MFP y con un control a base de 1100 ppm de FNa, no obteniendo resultados concluyentes83. Biomin© se ha evaluado en tres estudios33,48,55. Patel et al., (2019) compararon una pasta con Biomin©con otra que incluía la tecnología Pro-Argin© y reportaron una mayor reducción al mes con la pasta de Biomin©-F© respecto a la fórmula Pro-Argin© y al control48. Aggarwal et al., (2019), en su ensayo compararon Novamin© con Biomin© y con cloruro de estroncio, resultando los tres productos efectivos en la reducción de la sensibilidad de forma similar55. Arshad et al., (2021) hallaron un efecto inmediato y a la semana más elevado con Pro-Argin© y con acetato de estroncio al 8% junto con FNa que con Biomin©, mientras que a las ocho semanas el efecto de Biomin© y Pro-Argin© se igualó33. La nanohidroxiapatita se ha evaluado en nueve estudios20,23,24,32,59,85-88. El estudio de Orsini et al., (2013) halló un efecto similar tras tres días de uso de una pasta con la tecnología Pro-Argin©, otra con estroncio y otra con nanocristales de hidroxiapatita y zinc23. En el mismo sentido apunta el estudio de Anand et al., (2017) tras cuatro semanas de uso de una pasta con nanohidroxiapatita al 1% frente a otra con Pro-Argin© 32.
En el estudio de Orsini et al., (2010), se comportó mejor que el nitrato potásico al 5% y 1450 ppm de FNa a las cuatro y ocho semanas20. Lee et al., (2015) compararon una pasta de nanohidroxiapatita al 20% y 8% de sílice con otra de cloruro de estroncio al 10% y carbonato cálcico al 10%, no hallando diferencias entre ambas a las cuatro semanas de tratamiento59. Polyakova et al., (2022) describieron una reducción significativa utilizando una pasta de nanohidroxiapatita con Zn y Mg, frente a otra con fluornanohidroxiapatita y otra con nanohidroxiapatita a las cuatro semanas24. Vano et al., (2014) y Vano et al., (2018) evaluaron una pasta de nanohidroxiapatita al 15% frente a una pasta fluorada y un placebo, y en ambos estudios resultó más eficaz que el flúor y que el placebo frente a estímulos táctiles y frente al aire tras dos y cuatro semanas de uso86,87. Vlasova et al., (2022) evaluaron una pasta que contenía hidroxiapatita y Polyol Germanium Complex (PGC) con el aminoácido teonina, resultando más eficaz que una pasta de 1450 ppm de FNa en la reducción de la sensibilidad al aire88.
El trifosfato cálcico se ha evaluado en un único estudio realizado por Jang et al., (2023) en el que demostraron que tanto una pasta que contenía trifosfato cálcico al 19% como una pasta con cloruro de estroncio al 10% reducían la sensibilidad durante cuatro semanas de uso sin diferencias entre ellas58.
Fluoruro y cloruro de estaño
El fluoruro de estaño al 0.454% se ha evaluado en 22 estudios60,42,71,72-74,89-104. Parkinson et al., (2013, 2015 y 2016) compararon el fluoruro de estaño con fluoruro sódico (1000 ppm), hallando un mayor efecto desensibilizante a las cuatro y ocho semanas con el fluoruro de estaño98-101. Chaknis et al., (2011) hallaron un mayor efecto desensibilizante a las ocho semanas con un dentífrico que contenía 0.3% triclosán, 2.0% PVM/ MA copolímero y NaF al 0.243% con una formulación específica de sílice que un dentífrico con fluoruro de estaño, hexametafosfato y lactato de zinc89. Creeth et al., (2019 a y b y 2021) obtuvieron mayor reducción de la sensibilidad con un compuesto a base de fluoruro de estaño que con un control a base de monofluorofosfato90-92. En la misma línea Day et al., (2010), Schiff et al., (2005), Sharma et al., (2013), y Tao et al., (2020), reportaron un mejor efecto con fluoruro de estaño que con 1450 ppm de fluoruro sódico93,102-104. El estudio de He et al., (2011a,) halló un efecto desensibilizante mayor con una pasta de fluoruro de estaño al 0.454% que con Pro-Argin© a los tres y 15 días de tratamiento42. En la misma línea He et al., (2014 a y b) hallaron un efecto inmediato mejor con el fluoruro de estaño que con una pasta de 1450 ppm de FNa o una de monofluorofosfato96,97. Sharma et al., (2010) compararon el nitrato potásico con Novamin© y con fluoruro de estaño, describiendo que las tres pastas redujeron la sensibilidad, pero fue más eficaz Novamin© 78. En el estudio de Gallob et al., (2017) compararon una pasta de nitrato potásico con una de 1150 ppm de fluoruro de estaño y con un control con 1150 de FNa, comportándose las dos pastas con una eficacia similar y superior a la del control a las cuatro y ocho semanas60. En el trabajo de Schiff et al., (2000) la asociación de nitrato potásico al 5% y fluoruro de estaño al 0.454% resultó ser más eficaz que la formulación de nitrato potásico al 5% y MFP al 5% a las dos, cuatro y ocho semanas de tratamiento101. En la misma línea apuntan los resultados obtenidos por Sowinski et al., (2000) y Sowinski et al., (2001a,b) que compararon una fórmula con nitrato potásico al 5%, fluoruro de estaño al 0.454% y 1450 ppm de FNa, que resultó ser más eficaz que una pasta control de 1450 ppm de FNa72-74.
El cloruro de estaño se ha evaluado en dos estudios64,104. Ni et al., (2010) utilizaron cloruro de estaño y 1450 ppm de FNa y lo compararon con una pasta con nitrato potásico, no hallando diferencias significativas entre ambos productos a las cuatro y ocho semanas64. Tao et al., (2020) compararon una pasta de fluoruro de estaño con una de cloruro de estaño y con una pasta fluorada de 1450 ppm FNa, no hallando diferencias entre las tres102.
Pasta con calcio y fosfato amorfo (ACP)
Ghassemi et al., (2009) compararon una pasta que contenía ACP y FNa al 0.24% frente a una pasta fluorada convencional, reportando una reducción de la sensibilidad con las dos pastas frente a los valores basales, aunque superior para el grupo ACP a las cuatro y ocho semanas de tratamiento105.
Fluorinol
El fluorinol ha sido evaluado por Bhowmik et al., (2021) quienes lo compararon con una pasta de CSPS al 7.5%. Con ambos productos se redujo la sensibilidad al tacto, al aire y al frío frente a los valores basales, siendo significativamente más eficaz el fluorinol a las tres y cuatro semanas106.
Pastas herbales
Se han evaluado pastas dentales cuya composición incluye diferentes hierbas, combinadas o no con otros agentes desensibilizantes en cuatro estudios17,43,62,107. Xia et al., (2020) compararon una pasta con Galla Chinensis al 2% y 1450 ppm FNa frente a otra que sólo incluía 1450 ppm de FNa, hallando mayor reducción de la sensibilidad al frío y al tacto con la primera107.
Kar et al, (2019) hallaron una mayor eficacia con una pasta de Pro-Argin© que con una pasta a base de sales de potasio (Sensodyne) y una fórmula herbal no comercial43. Majji et al., (2016) emplearon cloruro de estroncio al 10% y la compararon con nitrato potásico al 5%, con una pasta con Novamin© y con una formulación herbal, hallando mejores resultados a las dos semanas, uno y dos meses con la pasta que contenía Novamin©, aunque en todos los grupos hubo mejora respecto a los valores basales17. Por último, Kumari et al., (2016) compararon una combinación de nitrato potásico al 5% con y sin una fórmula herbal (Oloaracia spinacia), no hallando diferencias en la reducción de la sensibilidad entre ambas pastas62.
Análisis cuantitativo de la eficacia inmediata y a las cuatro semanas de tratamiento mediante el metaanálisis en red (MAR)
Se presentan los resultados del MAR analizando el efecto inmediato (tras la aplicación y hasta los tres días) y a las cuatro semanas evaluados de forma independiente mediante estímulo de aire y estímulo táctil.
Efecto inmediato frente a estímulo de aire
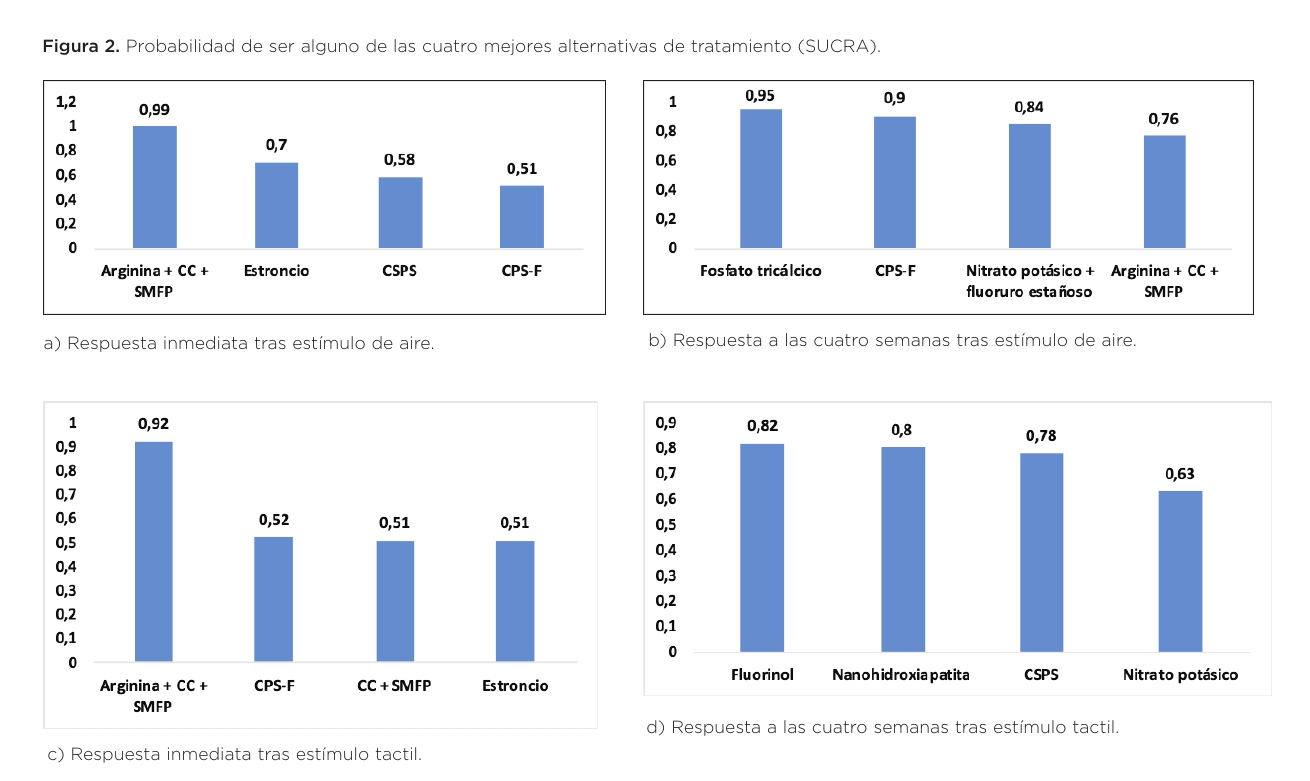
Se han incluido en el metaanálisis en red cinco estudios que analizan siete pastas dentales con principios activos diferentes con 16 pares de comparaciones. Tomando como referencia de tratamiento el flúor, en la tabla 1 se muestran las comparaciones del resto de tratamientos frente al flúor. Únicamente la tecnología Pro-Argin© tuvo un efecto desensibilizante significativamente superior al del flúor. La figura 3a recoge la probabilidad de ser el mejor tratamiento inmediato frente a estímulo de aire, analizado mediante el método SUCRA, hallándose que las pastas que incorporan la tecnología Pro-Argin© alcanzan un 99% de probabilidad de ser la mejor alternativa, seguida de las que contienen estroncio con un 70%.
Efecto a las cuatro semanas frente a estímulo de aire
Se han incluido 40 estudios que analizaron 22 tratamientos diferentes con 67 pares de comparaciones. Se ha tomado como tratamiento de referencia el placebo para estimar la diferencia de medias estandarizada (Figura 2). De los 22 tratamientos encontramos cuatro que muestran diferencias significativas respecto del placebo: Formulación Pro-Argin© (p=0.005), Biomin© (p=0.001), Novamin© (p =0.009) y fosfato tricálcico (p=0.004). El fosfato tricálcico presenta una probabilidad del 95% de ser el mejor. Le sigue Biomin©-F con un 90% y en tercer lugar aparecería nitrato potásico + fluoruro estañoso con un 84%. La tabla 3b representa en un gráfico de barras los 22 tratamientos ordenados de mayor a menor probabilidad.
Efecto inmediato tras estímulo táctil
Se han incluido en el metaanálisis en red cuatro estudios que analizan seis tratamientos diferentes con 13 pares de comparaciones. Al realizar una comparación del efecto de los seis tratamientos incluidos, se ha tomado como tratamiento de referencia el flúor para estimar la diferencia de medias estandarizada (Tabla 3). Las pastas con la tecnología Pro-Argin© han mostrado diferencias significativas (p=0.008) respecto del valor de referencia. La probabilidad de ser el mejor tratamiento determinado por el método SUCRA a partir de 1000 simulaciones, muestra que la tecnología Pro-Argin© presenta una probabilidad de ser el mejor tratamiento en el 92% de los casos (Tabla 3c).
Efecto a las 4 semanas tras estímulo táctil
Se han incluido en el Network metaanálisis 29 estudios que analizan 15 tratamientos diferentes con 44 pares de comparaciones. Al realizar una comparación del efecto de los 15 tratamientos incluidos, se ha tomado como tratamiento de referencia el placebo para estimar la diferencia de medias estandarizada (tabla 4). Cuatro tratamientos de los 15 incluidos han mostrado una eficacia significativamente mayor respecto del tratamiento referencia: Novamin© (p=0.010), fluorinol (p=0.047), nanohidroxiapatita (p=0.002) y nitrato potásico + fluoruro estañoso (p 0.001). La probabilidad de ser el mejor tratamiento determinado por el método SUCRA indica que el nitrato potásico en combinación con el fluoruro estañoso ofrece la mayor probabilidad de ser el mejor tratamiento con un 99%, seguido por el fluorinol con 82% y la nanohidroxiapatita 80%. La figura 3d representa en un gráfico de barras los 15 tratamientos ordenados de mayor a menor probabilidad.
La Tabla 4 final aporta una guía práctica de uso para el profesional con un resumen de las alternativas de tratamiento más relevantes halladas en el presente estudio.
DISCUSIÓN
Según nuestro conocimiento, desde el año 2000, se han publicado 11 metaanálisis en los que se evalúa la efectividad de las pastas dentífricas con diferentes agentes activos.
Se han incluido en el estudio formulaciones comercializadas en pastas dentífricas o formulaciones no comercializadas que contenían agentes activos incluidos en pastas comerciales, pero a otras concentraciones. El hecho de no ser restrictivos en este sentido y el de incluir diferentes productos hace que en la revisión cualitativa se hayan incluido 95 artículos y 64 en el MAR. Otros MA son más restrictivos respecto a los productos evaluados, los tiempos o los procedimientos de medida108-117. Según nuestro conocimiento, el MAR de Pollard et al., en 2023, es el más reciente hasta ahora e incorporó en la RS 62 estudios y 32 en el MAR. Estos autores evaluaron pastas dentífricas, pero solo incluyeron los ECAs que tuvieran dos o más formas diferentes de medir la HS118. El presente estudio se justifica porque no es restrictivo en cuanto a los métodos de medida, ni a los componentes de las pastas dentales analizadas. Los participantes en los ECAs deben de ser mayores de edad y en un número igual o superior a 10 participantes por grupo y considera los trabajos publicados desde el año 2000 en adelante.
En el MAR, para el análisis del efecto inmediato, se incluyeron estudios que analizaban la respuesta inmediatamente después de la aplicación y hasta los tres días de aplicación del agente desensibilizante. Cuando se evaluó la respuesta a estímulos de aire medida con la escala de Schiff se halló que la formulación Pro-Argin© presentaba una probabilidad de ser el mejor tratamiento de un 99%, con diferencias significativas respecto al flúor. Estos resultados son coincidentes con los hallados por Pollard et al., (2023)118. El mecanismo de acción de esta tecnología se basa en la formación de compuestos a base de calcio y fosfato que ocluyen los túbulos dentinarios, de forma similar a los vidrios bioactivos como Novamin© u otros biocristales. Estos compuestos parecen ser resistentes a la acción de los agentes físicos y químicos gracias al aumento de la densidad mineral de la dentina y al bloqueo y sellado de los túbulos dentinarios. Además, la tecnología Pro-Argin©, contiene arginina que es un aminoácido con carga positiva a pH fisiológico y bicarbonato con capacidad tampón que mantienen la estabilización del pH salival en condiciones de alcalinidad, favoreciendo la deposición de compuestos calcio y fosfato, que se ha comentado anteriormente. Gracias a esta formulación se obtiene un efecto inmediato que se puede mantener en el tiempo si se continúa utilizando el producto119-120. Como segunda opción de eficacia, se hallaban los compuestos a base de estroncio (70%), aunque en este caso sin diferencia significativa con el flúor. Las pastas basadas en estroncio o en compuestos estañosos con sílice, actúan bloqueando los túbulos dentinarios mediante una fina capa de partículas. Las formulaciones de estroncio han variado con el tiempo, siendo las más recientes las basadas en acetato de estroncio con flúor, las cuales han sustituidos a compuestos a base de cloruro de estroncio. La evidencia disponible no es demasiado concluyente en cuanto a la mayor eficacia de unos u otros compuestos a base de estroncio o la incorporación de sílice, no hallándose diferencias en el potencial desensibilizante en estudios clínicos ni en la reducción del flujo de fluidos en estudios in vitro. Por otro lado, algunas formulaciones incorporan además nitrato potásico, de forma que combinan dos mecanismos de acción, el bloqueo de los túbulo dentinarios con la reducción de la respuesta nerviosa a los estímulos121. A las cuatro semanas la formulación Pro-Argin© volvió a ser significativamente superior frente a un placebo, junto con compuestos a base de CPS-F (Biomin©) o CPS (Novamin©) y fosfato tricálcico, siendo la probabilidad de ser el mejor el fosfato tricálcico con un 95% seguido de CPS-F con el 90% y la formulación Pro-Argin© con el 76%. Martins al., (2023) hallaron un efecto desensibilizante similar a las cuatro semanas entre la arginina y el Novamin©. Los biocristales basados en fosfosilicato de calcio han demostrado tener potencial para liberar calcio y fosfato al exponerlos a un entorno acuoso. Los iones de calcio y fosfato que se liberan crean una capa de Ca-P en la superficie del diente que cristaliza en forma de hidroxiapatita cuando el pH aumentabrevemente. Estudios experimentales han demostrado que, el cepillado único con dentífrico a base de Novamin©, disminuye significativamente los túbulos abiertos en la capa superficial de dentina expuesta. Esta capa es resistente a los desafíos ácidos y resistente a las fuerzas mecánicas, debido a la liberación continua de calcio(119. La formulación de intrato potásico combinado con fluoruro de estaño presentó una probabilidad del 84% de ser el mejor desensibilizante, aunque sin diferencias significativas frente al placebo (p=0.09). Se ha demostrado que las sales de potasio interrumpen la respuesta neuronal a los estímulos dolorosos. De hecho, son los únicos compuestos que han sido validados para el alivio de la sensibilidad a través de este mecanismo. Aunque el potasio puede proporcionar un alivio eficaz, estudios clínicos han demostrado repetidamente que se necesitan al menos dos semansa de uso dos veces al día para mostrar reducciones medibles de la sensbilidad y períodos de tiempo más largo, generalmente de cuatro a ocho semanas, para demostrar niveles significativos de alivio del dolor. Según los datos disponibles, parece que los dentífricos a base de potasio no proporcionan un alivio instantáneo de la hipersensibilidad dentinaria114. Las sales de potasio se formulan on otros componentes en muchas ocasiones, como sucede en los estudios analizados en este NMA, en el que se han formulado con fluoruro de estaño, con fluoruro de estaño y fluoruro sódico, con zinc, heametafosfato y fluoruro sódico, siendo la formulación con fluoruro estañoso la que ha demostrado mayor probabilidad de efecto desensibilizante.
En el caso de la respuesta a estímulos táctiles, se realizó el análisis de forma similar a los estímulos con aire, aunque el número de estudios ni los productos analizados fueron los mismos ne todos los periodos. El efecto inmediato, considerado hasta tres días, se evaluó en cuatro estudios con seis tratamientos, hallándose que la formulación Pro-Argin© fue la que proporcionó un efecto mejor frente al flúor con una probabilidad del 92%.
A las cuatro semanas, se analizaron 29 estudios con 15 tratamientos, el CSPS (Novamin©), el fluorinol, la nanohidroxiapatita y el nitrato potásico combinado con fluoruro de estaño mostraron resultados de desensibilización significativamente mejores que el placebo. La mejor probabilidad la proporcionó esta última formulacion siendo del 99%, seguida del fluorinol del 82%, la nonohidroxiapatita del 80% y el CSPS (Novamin©) del 78%.
Entre las limiticaciones del presente estudio, hay que destacar que algunos de los productos comerciales que se han incluido han cambiado de formulación en el tiempo, por lo que, a la hora de hacer recomendaciones, un nombre comercial puede no corresponder al agente activo que tenía con anterioridad. Por este motivo, toda la información aportada se refiere a los agentes y no a productos comercializados. Por otro lado, algunas formulaciones comerciales no están disponibles en todos los países, ni el nombre o la composición del producto es la misma. Por tanto, el haber incluido formulaciones no comercializadas con concentraciones de agentes activos diferentes a las presentaciones comerciales, aporta más información científica, pero dificulta establecer una recomendación que el usuario pueda adquirir comercialmente.
Además, las escalas de medida utilizadas son muy variadas y a veces es difícil establecer comparaciones entre las diferentes escalas. Por otro lado, la mayoría de los métodos de medida tienen un cierto grado de subjetividad que pudiera aportar cierta imprecisión a las medidas. Así mismo no en todos los estudios había un placebo o un control negativo, algunos estudios comparaban diferentes productos con diferentes agentes activos, mientras otros si aportaban un control, positivo o negativo o ambos.
Por su parte, las medidas aportadas de cambio de sensibilidad no se expresan de la misma manera en todos los estudios, hallándose información sobre valores medios e intervalos de confianza de medidas, porcentajes de reducción de sensibilidad, diferencias de sensibilidad entre valores basales y los distintos momentos del estudio, etcétera. Esta heterogeneidad en la información de los datos es uno de los factores que ha impedido incorporar al MAR algunos de los estudios.
Aunque los metaanálisis en red permiten establecer comparaciones aparentemente coherentes y válidas, al interpretar los resultados hay que establecer siempre la asunción del principio de transitividad sobre la evidencia indirecta, es decir, si un fármaco B es mejor que A, y A es mejor que C, entonces se asume que B es mejor que C y de consistencia (grado de acuerdo entre la evidencia directa e indirecta). La mayoría de las técnicas disponibles en la actualidad para identificar potenciales inconsistencias están en continuo desarrollo y/o presentan importantes limitaciones como, por ejemplo, una escasa potencia estadística122.
Por último, es muy importante que los diferentes estudios incluidos sean comparables (similitud metodológica, poblaciones estudiadas, dosis utilizadas, procedimientos, medidas de resultados, tiempo de seguimiento, etcétera), además de una evaluación de la calidad metodológica de los estudios individuales que garantice que los sesgos o errores sistemáticos son mínimos; y que la variabilidad (heterogeneidad) entre los estudios no es excesiva. Los metaanálisis en red realizados en el marco una revisión sistemática rigurosa podría servir como fuente de información complementaria, no excluyente y generadora de hipótesis para futuros estudios, pudiendo así contribuir a facilitar la aplicación de los resultados de la investigación a la práctica clínica123. Tras esta revisión sistemática y MAR, puede concluirse que el mejor efecto inmediato respecto a los estímulos de aire y táctil, lo proporcionó la tecnología Pro-Argin©. A partir de las cuatro semanas los productos basados en biocristales, Pro-Argin©, y la formulación de nitrato potásico en combinación con el fluoruro de estaño proporcionarían la mayor probabilidad de ser efectivos en el tratamiento de la hipersensibilidad.
BIBLIOGRAFÍA
1. Holland GR, Narhi MN, Addy M, Gangarosa L, Orchardson R. Guidelines for the design and conduct of clinical trials on dentine hypersensitivity. J Clin Periodontol. 1997;24:808-13.
2. Canadian Advisory Board on Dentin Hypersensitivity. Consensus based recommendations for the diagnosis and management of dentin hypersensitivity. J Can Dent Assoc. 2003; 69:221-6.
3. Brannstrom M. Dentin sensitivity and aspiration of odontoblasts. J Am Dent Assoc 1963;66:366-70.
4. Hossain MZ, Bakri MM, Yahya F, Ando H, Unno S, Kitagawa J. The Role of Transient Receptor Potential (TRP) Channels in the Transduction of Dental Pain. Int J Mol Sci. 2019;20:526.
5. Sole-Magdalena, A.; Martinez-Alonso, M.; Coronado, C.A.; Junquera, L.M.; Cobo, J.; Vega, J.A. Molecular basis of dental sensitivity: The odontoblasts are multisensory cells and express multifunctional ion channels. Ann Anat. 2018; 215: 20–9.
6. Shibukawa, Y.; Sato, M.; Kimura, M.; Sobhan, U.; Shimada, M.; Nishiyama, A.; Kawaguchi, A.; Soya, M.; Kuroda, H.; Katakura, A.; et al. Odontoblasts as sensory receptors: Transient receptor potential channels, pannexin-1, and ionotropic ATP receptors mediate intercellular odontoblast-neuron signal transduction. Pflug Arch. 2015; 467: 843–63.
7. West NX, Davies M, Sculean A, Jepsen S, Faria-Almeida R, Harding M, Graziani F, Newcombe RG, Creeth JE, Herrera D. Prevalence of dentine hypersensitivity, erosive tooth wear, gingival recession and periodontal health in seven European countries. J Dent. 2024 Nov;150:105364.
8. Favaro Zeola L, Soares PV, Cunha-Cruz J. Prevalence of dentin hypersensitivity: Systematic review and metaanalysis. J Dent. 2019;81:1-6.
9. Bekes K, John MT, Schaller HG, Hirsch C. Oral health-related quality of life in patients seeking care for dentin hypersensitivity. J Oral Rehabil 2009;36:45–51.
10. Douglas-de-Oliveira DW, Vitor GP, Silveira JO, Martins CC, Costa FO, CotaLOM. Effect of dentin hypersensitivity treatment on oral health related quality of life – a systematic review and meta-analysis. J Dent. 2018;71:1–8.
11. Machuca C, Baker SR, Sufi F, Mason S, Barlow A, Robinson PG. Derivation of a short form of the Dentine Hypersensitivity Experience Questionnaire. J Clin Periodontol. 2014;41 (1):46-51.
12. Martins CC, Firmino RT, Riva J, J.Ge L,Carrasco-Labra A, Brignardello-Petersen R, Colunga-Lozano LE, Granville-Garcia AF, Costa FO, Yepes-Nuñez JJ,.Zhang Y, Schünemann HJ. Desensitizing Toothpastes for Dentin Hypersensitivity: A Network Meta-analysis. J Dent Res. 2020;99: 514-22.
13. Pollard AJ, Khan I, Davies M, Claydon N, West NX. Comparative efficacy of self-administered dentifrices for the management of dentine hypersensitivity - A systematic review and network meta-analysis. J Dent. 2023:130:104433.
14. Shiau H. Dentin hypersensitivity. J Evid Based Dent Pract. 2012;12(3 Suppl):220-28.
15. Nathoo S, Delgado E, Zhang YP, DeVizio W, Cummins D, Mateo LR. Comparing the efficacy in providing instant relief of dentin hypersensitivity of a new toothpaste containing 8.0% arginine, calcium carbonate, and 1450 ppm fluoride relative to a benchmark desensitizing toothpaste containing 2% potassium ion and 1450 ppm. J Clin Dent. 2009; 20: 123–30.
16. Pereira R, Chava VK. Efficacy of a 3% potassium nitrate desensitizing mouthwash in the treatment of dentinal hypersensitivity. J Periodontol. 2001; 72: 1720–5.
17. Majji P, Murthy KR. Clinical efficacy of four interventions in the reduction of dentinal hypersensitivity: A 2-month study. Indian J Dent Res. 2016; 27: 477–82.
18. Parkinson CR, Constantin P, Goyal C, Hall C. An exploratory clinical trial to evaluate the efficacy of an experimental dentifrice formulation in the relief of dentine hypersensitivity. J Dent. 2017; 56: 39–44.
19. Litkowski L, Greenspan DC. A clinical study of the effect of calcium sodium phosphosilicate on dentin hypersensitivity--proof of principle. J Clin Dent. 2010; 21: 77-81.
20. Orsini G, Procaccini M, Manzoli L, Giuliodori F, Lorenzini A, Putignano A. A double-blind randomized-controlled trial comparing the desensitizing efficacy of a new dentifrice containing carbonate/hydroxyapatite nanocrystals and a sodium fluoride/potassium nitrate dentifrice. J Clin Periodontol. 2010; 37: 510–7.
21. Li Y, Lee S, Zhang YP, Delgado E, Devizio W, Mateo LR. Comparison of clinical efficacy of three toothpastes in reducing dentin hypersensitivity. J Clin Dent. 2011; 22: 113–20.
22. Liu H, Hu D. Efficacy of a Commercial Dentifrice Containing 2% Strontium Chloride and 5% Potassium Nitrate for Dentin Hypersensitivity: A 3-Day Clinical Study in Adults in China. Clin Ther. 2012; 34: 614–22.
23. Orsini G, Procaccini M, Manzoli L, Sparabombe S, Tiriduzzi P, Bambini F, Putignano A. A 3-day randomized clinical trial to investigate the desensitizing properties of three dentifrices. J Periodontol. 2013; 84: e65–73.
24. Polyakova M, Sokhova I, Doroshina V, Arakelyan M, Novozhilova N, Babina K. The effect of toothpastes containing hydroxyapatite, fluoroapatite, and Zn-Mg-hydroxyapatite nanocrystals on dentin hypersensitivity: A randomized clinical trial. J Int Soc Prev Community Dent. 2022; 12: 252–9.
25. Jacobsen PL & Bruce G. Clinical dentin hypersensitivity: Understanding the causes and prescribing a treatment. J Contemp Dent Pract. 2001; 2: 1-12.
26. Page MJ, McKenzie JE, Bossuyt PM, Boutron I, et al. The PRISMA 2020 statement: an updated guideline for reporting systematic reviews. BMJ. 2021;372:n71
27. Minozzi S, Cinquini M, Gianola S, Gonzalez-Lorenzo M, Banzi R. The revised Cochrane risk of bias tool for randomized trials (RoB 2) showed low interrater reliability and challenges in its application. J Clin Epidemiol. 2020:126:37-44.
28. Shim SR, Kim SJ, Lee J, Rucker G. Network meta-analysis: application and practice using R software. Epidemiol Health. 2019:41:e2019013.
29. Salanti G, Ades AE, Ioannidis JP. Graphical methods and numerical summaries for presenting results from multiple-treatment meta-analysis: an overview and tutorial. J Clin Epidemiol. 2011; 64: 163–71.
30. Acharya AB, Surve SM, Thakur SL. A clinical study of the effect of calcium sodium phosphosilicate on dentin hypersensitivity. J Clin Exp Dent. 2013;5:e18-22.
31. Langrial RZ, Kundi JA, Batool SM, Shah SLS, Rahim A, FarooQ A. Comparison of efficacy of dentrifrice containing 8% arginine and 8% strontium acetate in reducing dentinal hypersensitivity. PJMHS. 2022; 16: 361-3.
32. Anand S, Rejula F, Sam JVG, Christaline R, Nair MG, Dinakaran S. Comparative Evaluation of Effect of Nano-hydroxyapatite and 8% Arginine Containing Toothpastes in Managing Dentin Hypersensitivity: Double Blind Randomized Clinical Trial. Acta Medica (Hradec Kralove). 2017;60:114-19.
33. Arshad S, Zaidi SJA, Farooqui WA. Comparative efficacy of BioMin-F, Colgate Sensitive Pro-relief and Sensodyne Rapid Action in relieving dentin hypersensitivity: a randomized controlled trial. BMC Oral Health. 2021 Oct 6;21:498.
34. Ayad F, Ayad N, Zhang YP, DeVizio W, Cummins D, Mateo LR. Comparing the efficacy in reducing dentin hypersensitivity of a new toothpaste containing 8.0% arginine, calcium carbonate, and 1450 ppm fluoride to a commercial sensitive toothpaste containing 2% potassium ion: an eight-week clinical study on Canadian adults. J Clin Dent. 2009;20:10-16.
35. Boneta ARE, Ramirez K, Naboa J, Mateo LR, Stewart B, Panagokos F, De Vizio W. Efficacy in reducing dentine hypersensitivity of a regimen using a toothpaste containing 8% arginine and calcium carbonate, a mouthwash containing 0.8% arginine, pyrophosphate and PVM/MA copolymer and a toothbrush compared to potassium and negative control regimens: an eight-week randomized clinical trial. J Dent. 2013a;41 Suppl 1:S42-9.
36. Devi Bala, RT, Dhayanand JV, Sangeetha S, Prakash PSG, Abirami T.Comparision of Commercially available Desensitizing Toothpastes in the Management of Dentin HypersensitivityA Randomized Controlled Clinical Trial. J Pharm Sci Res. 2019; 11(5):1787-9
37. Docimo R, Montesani L, Maturo P, Costacurta M, Bartolino M, Zhang YP, DeVizio W, Delgado E, Cummins D, Dibart S, Mateo LR. Comparing the efficacy in reducing dentin hypersensitivity of a new toothpaste containing 8.0% arginine, calcium carbonate, and 1450 ppm fluoride to a benchmark commercial desensitizing toothpaste containing 2% potassium ion: an eight-week clinical study in Rome, Italy. J Clin Dent. 2009;20:137-43.
38. Docimo R, Perugia C, Bartolino M, Maturo P, Montesani L, Zhang YP, DeVizio W, Mateo LR, Dibart S. Comparative evaluation of the efficacy of three commercially available toothpastes on dentin hypersensitivity reduction: an eight-week clinical study. J Clin Dent. 2011;22:121-7.
39. Franca IL, Sallum EA, Vale HF, Casati MZ, Sallum AW, Stewart B. Efficacy of a combined in office/home use desensitizing system containing 8% arginine and calcium carbonate in reducing dentin hypersensitivity: An 8 week randomized clinical study. Am J Dent. 2015; 28:45-50.
40. Fu Y, Sufi F, Wang N, Young S, Feng X. An Exploratory Randomised Study to Evaluate the Efficacy of an Experimental Occlusion-based Dentifrice in the Relief of Dentin Hypersensitivity. Oral Health Prev Dent. 2019; 17:107-15.
41. Hall C, Mason S, Cooke J. Exploratory randomised controlled clinical study to evaluate the comparative efficacy of two occluding toothpastes – a 5% calcium sodium phosphosilicate toothpaste and an 8% arginine/calcium carbonate toothpaste – for the longer-term relief of dentine hypersensitivity. J Dent. 2017; 60:36-43.
42. He T, Chang J, Cheng R, Li X, Sun L, Biesbrock AR. Clinical evaluation of the fast onset and sustained sensitivity relief of a 0.454% stannous fluoride dentifrice compared to an 8.0% arginine-calcium carbonate-sodium monofluorophosphate dentifrice. Am J Dent. 2011a; 4:336-40.
43. Hegde S, Rao BHS, Kakar RC, Kakar A. A comparison of dentifrices for clinical relief from dentin hypersensitivity using the jay sensitivity sensor probe. Am J Dent. 2013; 26:29-36.
44. Hughes N, Mason S, Jeffery P, Welton H, Tobin M, O´Shea C, et al., A comparative clinical study investigating the efficacy of a test dentifrice containing 8% strontium acetate and 1040 ppm sodium fluoride versus a marketed control dentifrice containing 8% arginine, calcium carbonate, and 145 ppm sodium monofluorophosphate in reducing dentinal hypersensitivity. J Cin Dent. 2010; 21:49-55.
45. Kar PP, Shaikh ZA, Hiremath AM, Vikneshan M. Comparison of the effectiveness of three different desensitizing toothpastes in reducing dentin hypersensitivity: A 4 week clinical study. J Conserv Dent. 2019; 22(2): 181-4.
46. Kakar A, Kakar K, Sreenivasan PK, DeVizio W, Kohli R. Comparison of the clinical efficacy in reducing dentin hypersensitivity of a new dentifrice containing 8% arginine, calcium carbonate and 1000 ppm sodium monofluorophosphate to a commercially available toothpaste containing 1000 ppm sodium monofluorophosphate: and eight-week clinical trial on adults in New Delhi, India. J Clin Dent. 2012a; 23:33-9.
47. Kakar A, Kakar K, Sreenivasan PK, DeVizio W, Kohli R. Comparison of the clinical efficacy of a new dentifrice containing 8% arginine, calcium carbonate and 1000 ppm fluoride to a commercially available sensitive toothpaste containing 2% potassium ion on dentin hypersensitivity: A randomized clinical trial. J Clin Dent. 2012b; 23:40-7.
48. Kakar A, Divart S, kakar K. Clinical assessment of a new dentifrice with 8% arginine and calcium carbonate on dentin hypersensitivity in an Indian population using a new measuring device: The Jay sensitivity sensor probe. Am J Dent. 2013; 26:13-20.
49. Li Y, Lee S, Zhang YP, Delgado E, Devizio W, Mateo LR. Comparison of clinical efficacy of three toothpastes in reducing dentin hypersensitivity. J Clin Dent. 2011; 22: 113–20.
50. Patel VR, Shettar L, Thakur S, Gillam D, Kamala DN. A randomised clinical trial on the efficacy of 5% fluorocalcium phosphosilicate-containing novel bioactive glass toothpaste. J Oral Rehabil. 2019; 46: 1121–6.
51. Schiff T, Mateo LR, Delgado E, Cummins D, Zhang YP, Devizio W. Clinical efficacy in reducing dentin hypersensitivity of a dentifrice containing 8.0% arginine, calcium carbonate, and 1450 ppm fluoride compared to a dentifrice containing 8% strontium acetate and 1040 ppm fluoride under consumer usage conditions before. J Clin Dent. 2011; 22: 128–38.
52. Schlee M, Rathe F, Bommer C, Bröseler F, Kind L. Selfassembling peptide matrix for treatment of dentin hypersensitivity: A randomized controlled clinical trial. J Periodontol. 2018; 89: 653–60.
53. Mason S, Hughes N, Sufi F, Bannon L, Maggio B, North M, Holt J. A comparative clinical study investigating the efficacy of a dentifrice containing 8% strontium acetate and 1040 ppm fluoride in a silica base and a control dentifrice containing 1450 ppm fluoride in a silica base to provide immediate relief of dentin hypersensitivity. J Clin Dent. 2010; 21: 42–8.
54. Zang P, Shaw D. A Randomized Clinical Study to Evaluate the Efficacy of an 8% (w/w) Strontium Acetate Dentifrice in Providing Relief from Dentinal Hypersensitivity. J Clin Dent. 2016; 27: 91–6.
55. Aggarwal SD, Borkar A, Borse N, Acharya A. Comparative evaluation of fluoro calcium phosphosilicate, calcium sodium phosphosilicate, and strontium chloride hexahydrate containing dentifrice for the treatment of dentin hypersensitivity: A randomized single-blind study. J Int Oral Health. 2019;11:404-11.
56. Antoniazzi RP, Machado ME, Grellmann AP, Santos RC, Zanatta FB. Effectiveness of a desensitizing agent for topical and home use for dentin hypersensitivity: a randomized clinical trial. Am J Dent. 2014;27(5):251-7.
57. Du Min Q, Bian Z, Jiang H, Greenspan DC, Burwell AK, Zhong J, Tai BJ. Clinical evaluation of a dentifrice containing calcium sodium phosphosilicate (novamin) for the treatment of dentin hypersensitivity. Am J Dent. 2008;21:210-4.
58. Jang JH, Oh S, Kim HJ, Kim DS. A randomized clinical trialfor comparing the efficacy f desensitizing toothpastes on the relief of dentin hypersensitivity. Scientific reports. 2023; 31;13(1):5271.
59. Lee SY, Jung HI, Jung BY, Cho YS, Kwon HK, Kim BI. Desensitizing efficacy of nano-carbonate apatite dentifrice and Er, Cr: YSGG Laser: A randomized clinical trial. Photomed Laser Surg. 2015; 33(1):9-14.
60. Gallob J, Sufi F, Amini P, Siddiqi M, Mason S. A randomised exploratory clinical evaluation of dentifrices used as controls in dentinal hypersensitivity studies. J Dent. 2017; 64:80-7.
61. Katanec T, Majstorovic M, Vranic DN, Kardum MI, Marks LA. New toothpaste to deal with dentine hypersensitivity: double-blind randomized controlled clinical trial. Int J Dent Hyg. 2018 Feb;16(1):78-84.
62. Kumari M, Naik S, Martande SS, Pradeep AR, Singh P. Comparative efficacy of a herbal and a non-herbal dentifrice on dentinal hypersensitivity: a randomized controlled clinical trial. JICD. 2016; :46-52.
63. Nathoo S, Delgado E, Zhang YP, DeVizio W, Cummins D, Mateo LR. Comparing the efficacy in providing instant relief of dentin hypersensitivity of a new toothpaste containing 8.0% arginine, calcium carbonate, and 1450 ppm fluoride relative to a benchmark desensitizing toothpaste containing 2% potassium ion and 1450 ppm. J Clin Dent. 2009; 20: 123–30.
64. Ni LX, He T, Chang A, Sun L. The desensitizing efficacy of a novel stannous-containing sodium fluoride dentifrice: An 8-week randomized and controlled clinical trial. Am J Dent. 2010; 23: 17b-21b.
65. Narongdej T, Sakoolnamarka R, Boonroung T. The effectiveness of a calcium sodium phosphosilicate desensitizer in reducing cervical dentin hypersensitivity: A pilot study. J Am Dent Assoc. 2010; 141: 995–9.
66. Pradeep AR, Sharma A. Comparison of clinical efficacy of a dentifrice containing calcium sodium phosphosilicate to a dentifrice containing potassium nitrate and to a placebo on dentinal hypersensitivity: A randomized clinical trial. J Periodontol. 2010; 81: 1167–73.
67. Pradeep AR, Agarwal E, Naik SB, Bajaj P, Kalra N. Comparison of efficacy of three commercially available dentrifices on dentinal hypersensitivity: A randomized clinical trial. Aust Dent J. 2012; 57: 429D34.
68. Pretha M, Setty S, Ravindra S. Dentinal hypersensitivity? - Can this agent be the solution? Indian J Dent Res. 2006; 17: 178–84.
69. Salian S, Thakur S, Kulkarni S, LaTorre G. A randomized controlled clinical study evaluating the efficacy of two desensitizing dentifrices. J Clin Dent. 2010; 21: 82–7.
70. Seong J, Newcombe RG, Foskett HL, Davies M, West NX. A randomised controlled trial to compare the efficacy of an aluminium lactate/potassium nitrate/hydroxylapatite toothpaste with a control toothpaste for the prevention of dentine hypersensitivity. J Dent. 2021; 108: 103619.
71. Sharma N, Roy S, Kakar A, Greenspan DC, Scott R. A clinical study comparing oral formulations containing 7.5% calcium sodium phosphosilicate (Novamin®), 5% potassium nitrate, and 0.4% stannous fluoride for the management of dentin hypersensitivity. J Clin Dent. 2010; 21: 88–92.
72. Sowinski JA, Battista GW, Petrone ME, Chaknis P, Zhang YP, DeVizio W, Volpe AR, Proskin HM. A new desensitizing dentifrice--an 8-week clinical investigation. Compend Contin Educ Dent. Suppl 2000; 11–6; quiz 28.
73. Sowinski JA, Bonta Y, Battista GW, Petrone D, DeVizio W, Petrone M, Proskin HM. Desensitizing efficacy of Colgate Sensitive Maximum Strength and Fresh Mint Sensodyne dentifrices. Am J Dent. 2000; 13: 116–20.
74. Sowinski J, Ayad F, Petrone M, DeVizio W, Volpe A, Ellwood R, Davies R. Comparative investigations of the desensitising efficacy of a new dentifrice. J Clin Periodontol. 2001; 28: 1032–6.
75. Surve SM, Acharya AB, Shetty A, Thakur SL. Efficacy of calcium sodium phosphosilicate in managing dentinal hypersensitivity. Gen Dent. 2012; 60: e308-11.
76. Wara-aswapati N, Krongnawakul D, Jiraviboon D, Adulyanon S, Karimbux N, Pitiphat W. The effect of a new toothpaste containing potassium nitrate and triclosan on gingival health, plaque formation and dentine hypersensitivity. J Clin Periodontol. 2005; 32: 53–8.
77. Docimo R, Montesani L, Maturo P, Costacurta M, Bartolino M, DeVizio W, Zhang YP, Dibart S. Desensitizing efficacy of a new toothpaste containing 5.5% potassium citrate: a 4-week clinical study. Am J Dent. 2007;20:209-11.
78. Hu D, Zhang YP, Chaknis P, Petrone ME, Volpe AR, DeVizio W. Comparative investigation of the desensitizing efficacy of a new dentifrice containing 5.5% potassium citrate: An eight week clinical study. J Clin Dent. 2004; 15:6-10.
79. Young S, Sufi F, Siddiqi M, Maclure R, Holt J. A Randomized Non-Inferiority Clinical Study to Evaluate the Efficacy of Two Dentifrices for Dentin Hypersensitivity. J Clin Dent. 2016; 27: 97–104.
80. Prasad KV V, Sohoni R, Tikare S, Yalamalli M, Rajesh G, Javali SB. Efficacy of two commercially available dentifrices in reducing dentinal hypersensitivity. Indian J Dent Res. 2010; 21: 224–30.
81. Yates R, Ferro R, Newcombe RG, Addy M. A comparison of a reformulated potassium citrate desensitising toothpaste with the original proprietary product. J Dent. 2005; 33: 19–25.
82. Rajesh KS, Hedge S, Kumar A, Shetty DG. Evaluation of the efficacy of a 5% calcium sodium phosphosilicate (Novamin®) containing dentifrice for the relief of dentinal hypersensitivity: A clinical study. Indian J Dent Res. 2012; 23: 363–7.
83. Sufi F, Hall C, Mason S, Shaw D, Kennedy L, Gallob JT. Efficacy of an experimental toothpaste containing 5% calcium sodium phosphosilicate in the relief of dentin hypersensitivity: An 8-week randomized study (Study 1). Am J Dent. 2016; 29: 93–100.
84. Fu Y, Sufi F, Wang N, Young S, Feng X. An Exploratory Randomised Study to Evaluate the Efficacy of an Experimental Occlusion-based Dentifrice in the Relief of Dentin Hypersensitivity. Oral Health Prev Dent. 2019; 17:107-15.
85. Rajesh KS, Hedge S, Kumar A, Shetty DG. Evaluation of the efficacy of a 5% calcium sodium phosphosilicate (Novamin®) containing dentifrice for the relief of dentinal hypersensitivity: A clinical study. Indian J Dent Res. 2012; 23: 363–7.
86. Vano M, Derchi G, Barone A, Covani U. Effectiveness of nano-hydroxyapatite toothpaste in reducing dentin hypersensitivity: a double-blind randomized controlled trial. Quintessence Int. 2014; 45: 703–11.
87. Vano M, Derchi G, Barone A, Pinna R, Usai P, Covani U. Reducing dentine hypersensitivity with nano-hydroxyapatite toothpaste: a double-blind randomized controlled trial. Clin Oral Investig. 2018; 22: 313–20.
88. Vlasova N, Samusenkov V, Novikova I, Nikolenko D, Nikolashvili N, Gor I, Danilina a. Clinical efficacy of hydroxyapatite toothpaste containing Polyol Germanium Complex (PGC) with threonine in the treatment of dentine hypersensitivity. Saudi Dent J. 2022; 34: 310–4.
89. Chaknis P, Panagakos FS, DeVizio W, Sowinski J, Petrone D, Proskin H. Assessment of hypersensitivity reduction of a dentifrice containing 0.3% triclosan, 2.0% PVM/MA copolymer, 0.243% NaF and specially-designed silica as compared to a dentifrice containing 0.454% stannous fluoride, sodium hexametaphosphate and zinc lactate and to a dentifrice containing 0.243% NaF on dentin hypersensitivity reduction: an 8-week study. Am J Dent. 2011;24 Spec No A:14A-20A.
90. Creeth J, Gallob J, Sufi F, Qaqish J, Gomez-Pereira P, Budhawant C, Goyal C. Randomised clinical studies investigating immediate and short-term efficacy of an occluding toothpaste in providing dentine hypersensitivity relief. BMC Oral Health. 2019a Jun 4;19:98.
91. Creeth J, Maclure R, Seong J, Gómez-Pereira P, Budhawant C, Sufi F, Holt J, Chapman N, West N. Three randomized studies of dentine hypersensitivity reduction after short-term SnF2 toothpaste use. J Clin Periodontol. 2019b;46(11):1105-15.
92. Creeth JE, Burnett GR. Efficacy of an Experimental Occlusion Technology Toothpaste in the Relief of Dentinal Hypersensitivity: An 8-week Randomised Controlled Trial. Oral Health Prev Dent. 2021 Mar 17;19:195-202.
93. Day T, Einwag J, Hermann JS, He T, Anastasia MK, Barker M, Zhang Y. A clinical assessment of the efficacy of a stannous-containing sodium fluoride dentifrice on dentinal hypersensitivity. J Contemp Dent Pract. 2010 Jan 1;11(1):E001-8.
94. He T, Barker ML, Qaquish J, Sharma N. Fast onset sensitivity relief of a 0.454% stannous fluoride dentifrice. J Clin Dent. 2011b; 22:46-50.
95. He T, Cheng R, Biesbrock AR, Chang A, Sun L. Rapid desensitizing efficacy of a stannous containing sodium fluoride dentifrice. J Clin Dent. 2011c; 22:40-5.
96. He T, Barker ML, Biesbrock A, Sharma N. A randomized controlled clinical trial to assess the desensitizing effect of a stannous fluoride dentifrice. Am J Dent. 2014a; 27: 106-10.
97. He T, Baker M, Biesbrock AR, Miner M, Qasqish J, Sharma N. A clinical study to assess the effect of a stabilized stannous fluoride dentifrice on hypersensitivity relative to a marketed sodium fluoride/triclosan control. J Clin Dent. 2014b; 25:13-8.
98. Parkinson CR, Hughes N, Hall C, Whelton H, Gallob J, Mason S. Three randomized clinical trials to assess the short-term efficacy of anhydrous 0.454% w/w stannous fluoride dentifrices for the relief of dentin hypersensitivity. Am J Dent. 2016; 29: 25–32.
99. Parkinson CR, Hughes N, Jeffery P, et al. The efficacy of an experimental dentifrice containing 0.454% w/w stannous fluoride in providing relief from the pain of dentin hypersensitivity: An 8-week clinical study. Am J Dent. 2013; 26: 25A-31A.
100. Parkinson CR, Jeffery P, Milleman JL, Milleman KR, Mason S. Confirmation of efficacy in providing relief from the pain of dentin hypersensitivity of an anhydrous dentifrice containing 0.454% with or without stannous fluoride in an 8-week randomized clinical trial. Am J Dent. 2015; 28: 190–6.
101. Schiff T, Bonta Y, Proskin HM, DeVizio W, Petrone M, Volpe AR. Desensitizing efficacy of a new dentifrice containing 5.0% potassium nitrate and 0.454% stannous fluoride. Am J Dent. 2000; 13: 111–5.
102. Schiff T, Saletta L, Baker RA, Winston JL, He T. Desensitizing effect of a stabilized stannous fluoride/Sodium hexametaphosphate dentifrice. Compend Contin Educ Dent. 2005; 26: 35–40.
103. Sharma D, McGuire JA, Amini P. Randomized trial of the clinical efficacy of a potassium oxalate-containing mouthrinse in rapid relief of dentin sensitivity. J Clin Dent. 2013; 24: 62–7.
104. Tao D, Ling MR, Feng X, et al. Efficacy of an anhydrous stannous fluoride toothpaste for relief of dentine hypersensitivity: A randomized clinical study. J Clin Periodontol. 2020; 47: 962–9.
105. Ghassemi A, Hooper W, Winston AE, Sowinski J, Bowman J, Sharma N. Effectiveness of a baking sda toothpaste delivering calcium and phosphate in reducing dentinal hypersensitivity. J Clin Dent. 2009; 20:203-10.
106. Bhowmik E, Pawar Chandrashekhar D, Sharma Hareesha M. Comparative evaluation of fluorinol and calcium sodium phosphosilicate-containing toothpastes in the treatment of dentin hypersensitivity. Int J Dent Hyg. 2021;19:421-8.
107. Xia Y, Yang Z, Li Y, Zhou Z. The Effects of a Toothpaste Containing the Active Ingredients of Galla chinensis and Sodium Fluoride on Dentin Hypersensitivity and Sealing of Dentinal Tubules: An In Vitro Study and an Eight-Week Clinical Study in 98 Patients. Med Sci Monit. 2020; 26.
108. Bae JH, Young-Kyun K, Seung-Kwon M. Desensitizing toothpaste versus placebo for dentin hypersensitivity: a systematic review and meta-analysis. J Clin Periodontol. 2015; 42: 131–41.
109. Yan B; Yi J, Li Y, Chen Y, Shi Z. Arginine-containing toothpastes for dentin hypersensitivity: systematic review and meta-analysis. Quintessence Int. 2013; 44: 709-23.
110. Grünberg C, Bauer F, Crispin A, Jakob M, Hickel R, Draenert ME. Effectiveness of dentifrices with new formulations for the treatment of dentin hypersensitivity - A meta-analysis. Am J Dent. 2017;30(4):221-6.
111. West NK, He T, Zou Y, DiGennaro J, Biesbrock A, Davies M. Bioavailable gluconate chelated stannous fluoride toothpaste meta-analyses: Effects on dentine hypersensitivity and enamel erosion. J Dent. 2021; 105: 103566.
112. Arantes D, Limeira FIR, Yamauti M, Moreira AN, Abreu LG, Magãlhaes CSD. Comparison of clinical efficacy of proargin and novamin toothpastes in relieving dentin hypersensitivity: A systematic review and meta-analysis. Oral Health Prev Dent. 2019; 17: 403–12.
113. Zhu M, Li J, Chen B, Mei L, Yao L, Tian J, Li H. The Effect of Calcium Sodium Phosphosilicate on Dentin Hypersensitivity: A Systematic Review and Meta-Analysis. PLoS One. 2015 Nov 6;10(11):e0140176.
114. Poulsen NS, Errboe M, Lescay Mevil Y, Glenny AM. Potassium containing toothpastes for dentine hypersensitivity. Cochrane Database Syst Rev. 2006;2006(3):CD001476.
115. Martins CC, Firmino RT, Riva J, J.Ge L,Carrasco-Labra A, Brignardello-Petersen R, Colunga-Lozano LE, GranvilleGarcia AF, Costa FO, Yepes-Nuñez JJ,.Zhang Y, Schünemann HJ. Desensitizing Toothpastes for Dentin Hypersensitivity: A Network Meta-analysis. J Dent Res. 2020;99: 514-22.
116. Hu ML, Zheng G, Zang YD, Xiang Y, Li XC, Lin G. Effect of desensitizing toothpastes on dentine hypersensitivity: A systematic review and meta-analysis. J Dent. 2018; 75: 12-21.
117. Hu ML, Zheng G, Lin H, Yang M, Zang YD, Han JM. Network meta-analysis on the effect of desensitizing toothpastes on dentine hypersensitivity. J Dent. 2019; 80: 103170.
118. Pollard AJ, Khan I, Davies M, Claydon N, West NX. Comparative efficacy of self-administered dentifrices for the management of dentine hypersensitivity - A systematic review and network meta-analysis. J Dent. 2023:130:104433.
119. Burwell A. Jennings D. Muscle D. Greenspan DC. NovaMin and dentin hypersensitivity--in vitro evidence of efficacy. J Clin Dent. 2010; 21:66-71.
120. Amaechi BT, Mathews SM, Ramalingam K, Mensinkai PK. Evaluation of nanohydroxyapatite containing toothpaste for occluding dentin tubules. Am J Dent 2015;28:33-9.
121. Kobler A, Kub O, Schaller HG, Gernhardt CR. Clinical effectiveness of strontium chloride-containing desensitizing agent over 6 months. A randomized double-blind placebo controlled study. Quintessence Int. 2008; 39: 329-35.
122. Freeman SC, Fisher D, White IR, Auperin A, Carpenter JR. Identifying inconsistency in network meta-analysis: Is the net heat plot a reliable method? Stat Med. 2019 Dec 20;38(29):5547-64. 123. Catalá-López F, Tobías A, Roque M. Conceptos básicos del metaanálisis en red. Aten Primaria. 2014;46:573-81.













