Crecimiento vertical asociado a implantes dentales para la rehabilitación de la mandíbula con extrema reabsorción en altura. Estudio retrospectivo con un seguimiento de 10 a 20 años
CORRESPONDING AUTHOR: Dr. Eduardo Anitua. Eduardo Anitua Foundation.
C/ Jose Maria Cagigal 19, 01007 Vitoria, Spain.
Telf: +34 945 160 653, e-mail: eduardo@fundacioneduardoanitua.org.
CONFLICTO DE INTERÉS: E.A. es el director científico de BTI Biotechnology Institute, una empresa de implantes dentales que investiga en los campos de la implantología oral y la tecnología PRGF-Endoret.
- Eduardo Anitua. DDS, MD, PhD
- Private practice in oral implantology, Eduardo Anitua Institute, Vitoria, Spain. Clinical researcher, Eduardo Anitua Foundation, Vitoria, Spain. University Institute for Regenerative Medicine and Oral Implantology - UIRMI (UPV/EHU-Fundación Eduardo Anitua), Vitoria, Spain.
RESUMEN
La rehabilitación implantológica en zonas mandibulares con atrofia vertical severa representa un desafío clínico, especialmente cuando se desea evitar técnicas invasivas de regeneración ósea. El uso de implantes cortos y extra-cortos en combinación con crecimiento vertical controlado sobre el implante podría representar una alternativa predecible y menos invasiva.
Objetivo: Evaluar la eficacia y estabilidad a largo plazo del crecimiento vertical óseo sobre implantes cortos y extracortos en sectores posteriores mandibulares con atrofia severa, utilizando únicamente hueso autólogo particulado vehiculizado con PRGF-Endoret.
Material y método: Estudio retrospectivo con seguimiento a largo plazo. Se incluyeron 16 pacientes tratados entre 2003 y 2009, con un total de 29 implantes colocados en mandíbula posterior. Se aplicó técnica de fresado biológico para recolección del injerto, que se aplicó alrededor del implante con PRGF-Endoret y cubierto con membrana de fibrina autóloga. Se evaluó ganancia ósea vertical, pérdida ósea crestal marginal y tasa de supervivencia del implante, con un seguimiento clínico y radiográfico de entre 10 y 20 años. El análisis estadístico se realizó mediante SPSS v15.0 y test de Kaplan-Meier.
Resultados: La ganancia ósea vertical media fue de 1,37 mm (±0,40), alcanzándose el 100% del objetivo propuesto en todos los casos. La pérdida ósea marginal media fue de 0,52 mm mesial y 0,57 mm distal. La tasa de supervivencia de los implantes fue del 100% durante el periodo de seguimiento. No se registraron complicaciones quirúrgicas ni protésicas.
Conclusión: El procedimiento de crecimiento vertical óseo sobre implantes cortos o extra-cortos mediante hueso autólogo y PRGF-Endoret es una técnica mínimamente invasiva, segura y predecible a largo plazo. Representa una alternativa viable frente a técnicas de regeneración ósea convencionales en casos de atrofia mandibular moderada a severa.
Palabras clave: rehabilitación implantológica, atrofia vertical, crecimiento vertical, implantes.
ABSTRACT
Implant Rehabilitation in Mandibular Areas with Severe Vertical Atrophy Implant rehabilitation in mandibular areas with severe vertical atrophy represents a clinical challenge, especially when invasive bone regeneration techniques are to be avoided. The use of short and extra-short implants in combination with controlled vertical bone growth over the implant could represent a predictable and less invasive alternative.
Objective: To evaluate the efficacy and long-term stability of vertical bone growth over short and extra-short implants in posterior mandibular areas with severe atrophy, using only particulate autologous bone combined with PRGF-Endoret.
Material and Methods: A retrospective study with long-term follow-up. Sixteen patients treated between 2003 and 2009 were included, with a total of 29 implants placed in the posterior mandible. A biological drilling technique was applied to collect the graft, which was placed around the implant mixed with PRGF-Endoret and covered with an autologous fibrin membrane. Vertical bone gain, marginal crestal bone loss, and implant survival rate were evaluated, with clinical and radiographic follow-up ranging from 10 to 20 years. Statistical analysis was performed using SPSS v15.0 and the Kaplan-Meier test.
Results: The mean vertical bone gain was 1.37 mm (±0.40), achieving 100% of the proposed objective in all cases. The mean marginal bone loss was 0.52 mm mesially and 0.57 mm distally. The implant survival rate was 100% during the follow-up period. No surgical or prosthetic complications were recorded.
Conclusion: The procedure of vertical bone growth over short or extra-short implants using autologous bone and PRGF-Endoret is a minimally invasive, safe, and predictable long-term technique. It represents a viable alternative to conventional bone regeneration methods in cases of moderate to severe mandibular atrophy.
Keywords: Implant rehabilitation, vertical atrophy, vertical growth, implants.
----
INTRODUCCIÓN
Para la rehabilitación con implantes dentales de zonas con atrofia ósea en altura, se han descrito en la literatura internacional múltiples procedimientos1-3. En el caso del maxilar superior, podemos utilizar injertos en bloque, regeneración ósea guiada, elevación de seno, elevación de fosa nasal o técnicas más complejas de distracción ósea1-5. En el caso de la mandíbula, existen menos opciones, siendo posible también la utilización de injertos en bloque, regeneración ósea guiada o lateralización del nervio dentario, siendo este último procedimiento considerado altamente invasivo y con mayores probabilidades de complicaciones neurólogicas posteriores5-7. En el documento de consenso de la sociedad europea de periodoncia, elaborado en el año 20087 , se analizan los diferentes procedimientos para lograr aumento óseo con el fin de la colocación posterior de implantes dentales. En este trabajo, los estudios en los que se utilizan procedimientos de regeneración ósea guiada para lograr crecimiento vertical reportan ganancias óseas de entre 2 y 8 mm, con complicaciones frecuentes de exposición de membranas y dehiscencias, que dificultan lograr los límites mayores de altura y en algunos casos incluso colocar los implantes. Los injertos en bloque aposicionales, muestran una elevada reabsorción incluso antes de la colocación del implante (hasta el 42% del volumen) y esta continúa posteriormente hasta 4,9 mm durante el seguimiento de los implantes entre 1 y 3 años. En este documento de consenso no se evalúa la lateralización del nervio dentario, estudiada en el trabajo de Abayev y cols7 donde en una revisión sistemática de este tópico ponen de manifiesto que este procedimiento puede causar problemas de tipo neurosensorial en los pacientes hasta en un 99,47% de los casos, en diferente grado, siendo únicamente eventos permanentes en el 0,53% de los casos. La elevación de seno, mediante abordaje lateral o mediante abordaje transcrestal es una técnica segura y de elevada predictibilidad siendo uno de los procedimientos de aumento vertical con mejor pronóstico. Se recomienda la utilización del abordaje crestal con alturas entre los 3 y los 6 mm y la colocación de implantes dejando la elevación abierta (ventana lateral) para casos de menos de 3 mm, aunque la tasa de eventos adversos es mayor, pero sin diferencias estadísticamente significativas, cuando se lleva a cabo el abordaje tradicional9 . La elevación de fosa nasal por su parte es una técnica menos extendida y con menor cantidad de estudios que evalúen su eficacia y seguridad, pero en una revisión sistemática elaborada por nuestro grupo de estudio, se pone de manifiesto que tiene una escasa tasa de complicaciones y una elevada supervivencia de los implantes insertados mediante este procedimiento (entre 89,2% hasta 100%)10.
Además de todos los procedimientos para lograr recuperar el volumen óseo perdido, tenemos la opción de los implantes cortos, extra-cortos y hoy en día lo que podríamos llamar “ultra-cortos”, con longitudes de 4,5 mm8-11. Con ellos podemos en muchas ocasiones rehabilitar sectores edéntulos deficitarios en altura ósea sin llegar a regenerar el volumen óseo perdido, con excelentes resultados, presentando cifras de supervivencia en función el tiempo de seguimiento y la longitud de los implantes estudiados de entre el 86,7% y 100% para implantes de hasta 6 mm con un seguimiento de 5 años11-16.
Aun con todas las opciones de procedimientos quirúrgicos y longitudes de implantes que tenemos actualmente en el mercado tenemos determinadas situaciones, donde los implantes extra-cortos no pueden ser colocados de forma directa, por falta de volumen óseo residual22. En algunos casos, podemos encontrarnos en situaciones donde el volumen óseo residual necesario para llevar a cabo la colocación directa de implantes extra-cortos en sectores mandibulares edéntulos se encuentre cerca de ser óptimo, siendo necesario el aumento únicamente de 1-2 mm de altura, no existiendo justificación clara de someter al paciente a un proceso quirúrgico de elevada morbilidad y escasa predictibilidad17-18. Para este tipo de situaciones se ha descrito el procedimiento de crecimiento vertical alrededor de los implantes cortos y extra-cortos. Nuestro grupo de estudio ha desarrollado una variante de esta técnica, en el año 201519 basada en la utilización de un fresado específico conservador con el lecho receptor, que permite la aproximación al canal del nervio dentario minimizando las complicaciones por compresión, gracias al uso de una fresa de corte frontal.
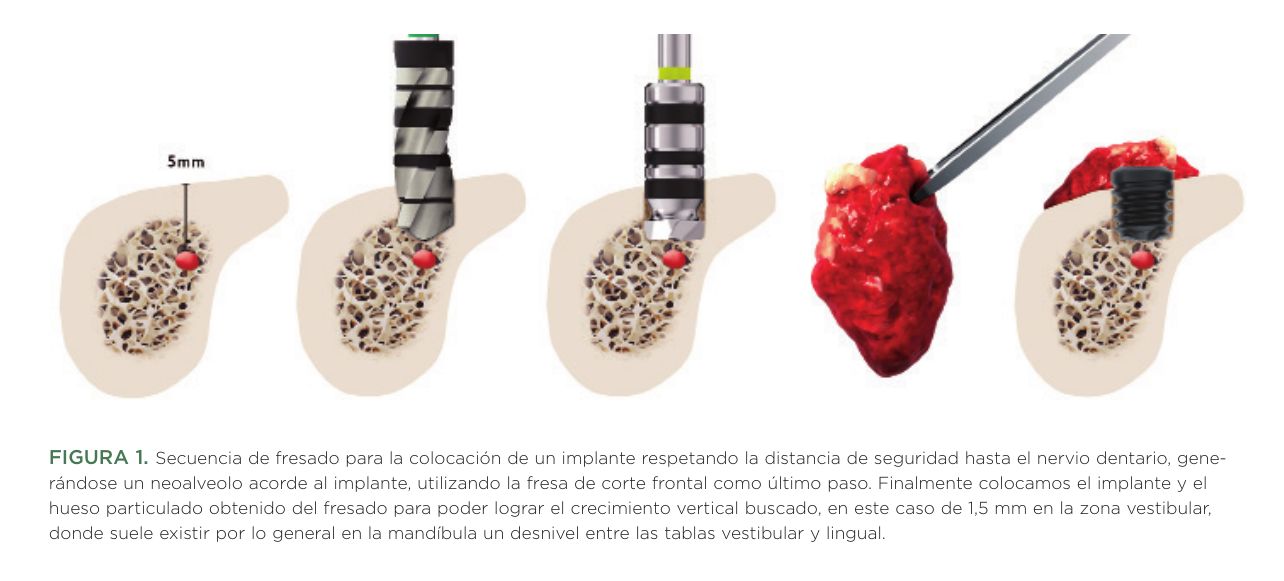
En esta técnica se utiliza todo el hueso autólogo obtenido del fresado (fresado biológico a bajas revoluciones)20-22, se conserva en PRGF-Endoret y posteriormente se utiliza para lograr el crecimiento vertical necesario de hasta 2 mm (figura 1). Este procedimiento está indicado en casos de atrofia moderada-severa donde un implante extra-corto quedaría ligeramente supracrestal en todo o parte de su circunferencia tras su inserción y tiene un recorrido importante en el tiempo, con buenos resultados19,23-25. La utilización de los factores de crecimiento para vehiculizar el hueso autólogo, la obtención del mismo de forma totalmente biológica y la superficie bioactiva de los implantes (UniCca® – Biotechnology Institute), hace posible que el hueso crezca sobre el implante como si de un andamio se tratase, generándose los milímetros de hueso necesarios evitándose de este modo la utilización de otros procesos más complejos19,26-29. En el siguiente artículo mostramos casos tratados mediante este procedimiento (implante corto o extra-corto y realización de crecimiento óseo vertical con hueso autólogo particulado obtenido del fresado y PRGF-Endoret), con un amplio seguimiento desde los 10 hasta los 20 años, evaluándose no solo el éxito del procedimiento en el período inicial, sino su trayectoria posterior en el largo plazo, así como la supervivencia de los implantes.
MATERIAL Y MÉTODO
Se han reclutado pacientes de forma retrospectiva en los que se insertaron implantes cortos y extracortos en sectores posteriores mandibulares con extrema atrofia horizontal y en los que se llevó a cabo crecimiento vertical de forma concomitante con hueso autólogo particulado embebido en PRGF-Endoret obtenido del fresado19 desde Enero de 2003 hasta Enero de 2009 y que mantuviesen seguimiento hasta Enero de 2024. Todos los pacientes fueron sometidos a un protocolo diagnóstico consistente en la realización de un Tac dental (cone-beam), modelos y encerado protésico. Desde estos fue realizada una guía quirúrgica que se utilizó en la inserción de los implantes. Antes de la inserción de los implantes se utilizó una pre-medicación antibiótica consistente en amoxicilina 2gr vía oral una hora antes de la intervención y paracetamol 1 gramo vía oral (como analgésico). Posteriormente los pacientes prosiguieron con un tratamiento de amoxicilina 500-750 mg vía oral cada 8 horas (según peso) durante 5 días. Los implantes fueron insertados por el mismo cirujano, mediante la técnica de fresado biológico22,30, con la última fresa de corte frontal, para adecuar el lecho al ápice del implante y minimizar el riesgo de lesión del nervio dentario19 (figura 1). El implante se coloca finalmente en posición con el motor quirúrgico prefijado a 25 Ncm terminándose la inserción del mismo con la llave de carraca manual para conocer exactamente el par de inserción. Todo el procedimiento se realiza mediante anestesia local con vasoconstrictor. Finalmente se realiza un cierre primario mediante un monofilamento no reabsorbible de 5/0 y se retira la sutura a los 10-15 días. El período de integración de los implantes es de tres meses y transcurrido este se realiza la segunda fase quirúrgica y colocación del pilar protésico (Multi-im® o biopilar) con la posterior rehabilitación protésica. Para estimar el crecimiento vertical necesario se lleva a cabo una fotografía intraoral una vez colocado el implante con una sonda periodontal calibrada y posteriormente en la segunda fase quirúrgica se repite la fotografía. Una vez cargado el implante, se realiza un seguimiento del lecho óseo y la conservación del crecimiento vertical mediante radiografías panorámicas y periapicales. Las radiografías periapicales se llevan a cabo con posicionador, para generar imágenes reproducibles y los pacientes son colocados para la radiografía panorámica con posicionador fijo en glablela y mentón, mordedor para zona interincisal con eje de línea media, plano bipupilar y frackfort (marca láser) y con los pies sobre marcas trazadas en el suelo, con el propósito de que sean altamente reproducibles los resultados. Sobre estas radiografías se llevan a cabo las mediciones necesarias para comprobar la estabilidad y pérdida ósea crestal de los implantes, así como realizar un seguimiento del aumento de volumen total en la mandíbula. Una vez obtenida la radiografía en formato digital es calibrada mediante un software específico (ImageJ) a través de una longitud conocida como es el implante dental. Una vez introducimos la medida de calibración, el programa informático realiza un cálculo basado en esta medida para eliminar la magnificación, pudiendo realizar mediciones lineales exentas de este error. La pérdida ósea crestal marginal se calculó midiendo desde el hombro del implante hasta el primer sitio donde el contacto hueso implante fuese evidente. La recolección de los datos fue llevada a cabo por un examinador independiente. El implante fue la unidad de análisis para la estadística descriptiva en cuanto a la localización, dimensiones del implante, y mediciones radiográficas. El paciente fue la unidad de medida para el análisis de la edad, sexo y la historia médica. Fue realizado un test de shapiro-Wilk sobre los datos obtenidos para constatar la distribución normal de la muestra.
La variable principal estudiada ha sido el crecimiento óseo vertical entorno a los implantes dentales. Como variables secundarias se han estudiado la supervivencia de los implantes y la pérdida ósea mesial y distal, así como el mantenimiento a largo plazo del crecimiento vertical obtenido en la fase inicial de colocación del implante y carga. La supervivencia de los implantes se calculó mediante el método de KaplanMeier. Los datos fueron analizados con SPSS v15.0 para Windows (SPSS Inc., Chicago, IL, USA).
RESULTADOS
Fueron reclutados 16 pacientes que cumplieron los criterios de inclusión y de seguimiento anteriormente mencionados en los que se colocaron 29 implantes con crecimiento vertical mediante hueso autólogo obtenido del fresado embebido en PRGF-Endoret. Todos los implantes se insertaron en zonas atróficas en altura de la mandíbula, siendo la posición más frecuentemente rehabilitada con este procedimiento la correspondiente al diente 46 con un 24,1% de los casos, seguida de las posiciones 36 y 37 con un 17,2% respectivamente. El resto de posiciones se muestran en la Figura 2.
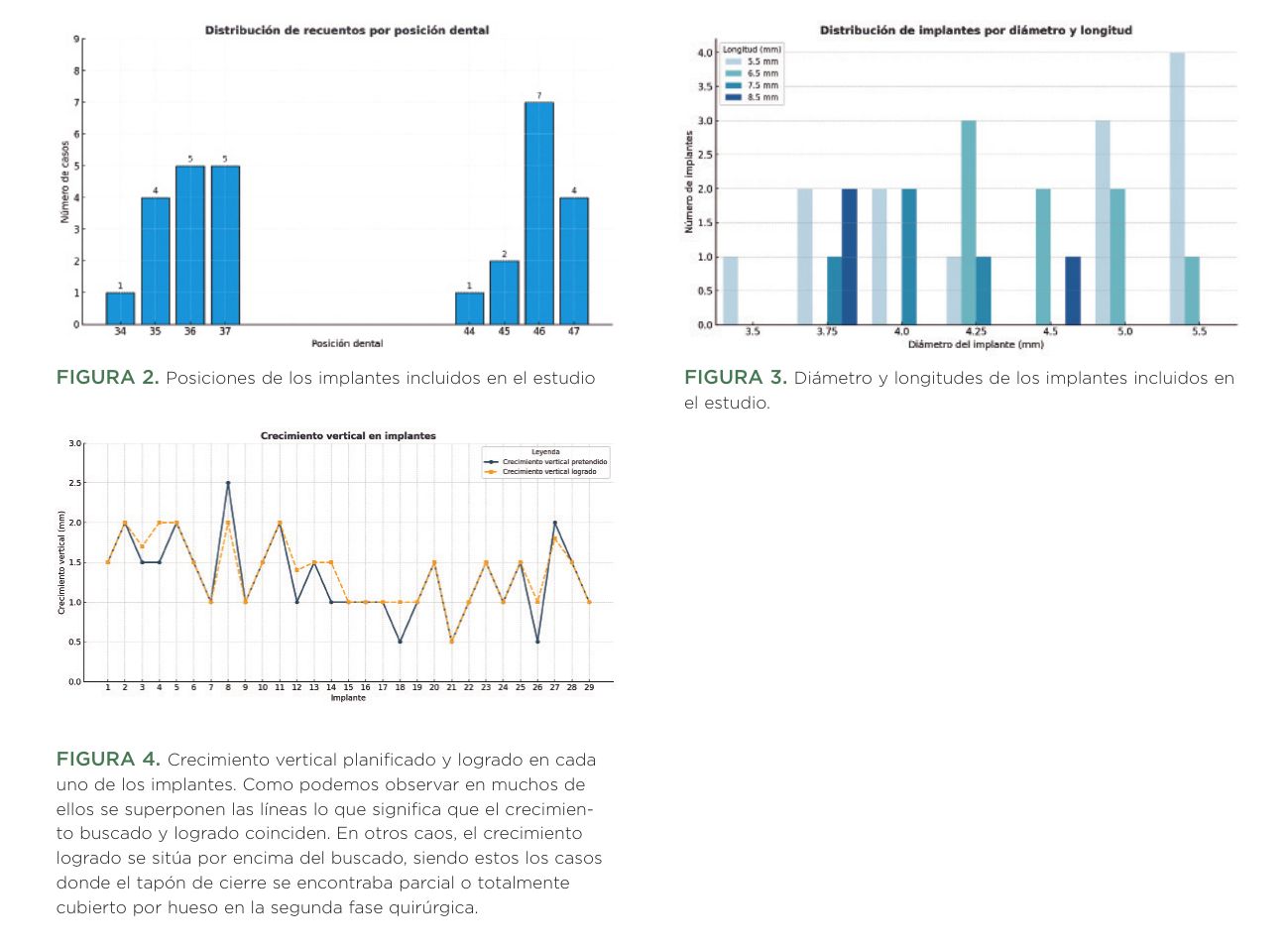
El diámetro de los implantes incluidos en el estudio osciló desde los 3,50 mm hasta los 5,50 mm siendo el más frecuente el de 4,25 mm (20,7%). La longitud de los implantes varió entre los 5,50 y los 8,50 mm siendo la más frecuente la de 5,50 mm (48,3%). Los diámetros y longitudes de todos los implantes se muestran en la Figura 3. El crecimiento vertical medio logrado del conjunto de los implantes estudiados fue de 1,37 mm (± 0,40). En el 37,9% de los casos el crecimiento buscado fue de 1 mm, y en el 34,5% de 1,50 mm. Se buscó un crecimiento vertical de 2 mm en el 13,8% de los casos y de 0,50 mm en el 10,3, siendo el 3,4% restante un crecimiento de 2,50 mm. En todos los casos, se logró el 100% del crecimiento vertical buscado, encontrándose el tapón de cierre parcial o totalmente cubierto por hueso en 22 de los 29 implantes. En la figura 4, se muestra una gráfica con el crecimiento vertical pretendido en el momento de realización de la técnica y el logrado.
Todos los crecimientos verticales fueron llevados a cabo con injerto óseo particulado autólogo, obtenido mediante fresado biológico y conservado y vehiculizado en PRGF-Endoret, cubierto con membranas de fibrina autóloga, sin el uso de otro tipo de membrana de aislamiento o de biomateriales.
Los pacientes fueron seguidos posteriormente entre 10 y 20 años, con una media de 11,72 años (± 2,94) con radiografías panorámicas y periapicales de control para evaluar la pérdida ósea crestal del implante en el que se realizó el procedimiento de crecimiento vertical. Durante este tiempo no se registró el fracaso de ninguno de los implantes, por lo que la supervivencia fue del 100%. La media de la pérdida ósea crestal de todos los implantes medida en mesial fue de 0,52 mm (±0,25) y la media de la pérdida ósea crestal distal de 0,57 (± 0,28). En todos los casos, al final del seguimiento, se encontró menor volumen óseo crestal que el logrado en la fase de crecimiento vertical, siendo negativo (pérdida mayor que el crecimiento logrado) en 6 de los casos. La media de pérdida ósea crestal para estos casos donde se produjo mayor pérdida que el crecimiento logrado fue de 0,40 mm (± 0,11). Si comparamos la media de la ganancia ósea inicial del procedimiento regenerativo con la media del nivel óseo final obtenemos una ganancia media de 0,56 mm (± 0,59), no siendo las diferencias entre ambas medias estadísticamente significativas (p=0,30).
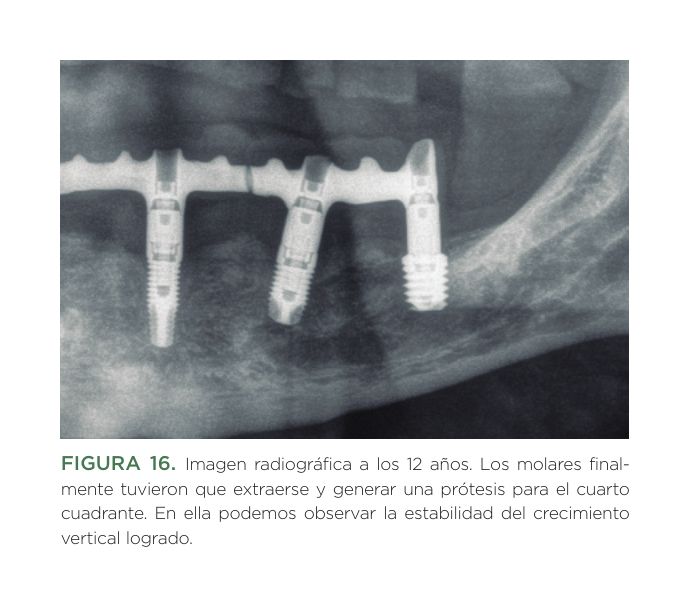
Todos los implantes se rehabilitaron mediante ferulización a otros implantes. En el 96,6% de los casos se llevó a cabo una prótesis atornillada mediante transepitelial múltiple (multi-im® Biotechnology institute) y en 3,4% restante (un único paciente) una prótesis cementada a través de biopilares fresados (biopilar® Biotechnology institute). En el 44,8 % de los casos, la prótesis fue completa, ferulizándose todos los implantes. En el 37,9% de los casos fueron puentes de 3 elementos y en el 13,8% de 2 elementos. Únicamente, el 3,4% fueron puentes de 5 elementos sin llegar a ser prótesis completas. Como antagonista, el 48,3% de los casos tuvieron dientes naturales, mientras que el 31% de los casos tenían como antagonista prótesis completas implantosoportadas. El 20,7% restante, presentaban como antagonista una prótesis completa removible convencional. En las Figuras 5 –15 se muestran dos de los casos incluidos en el estudio.
DISCUSIÓN
El crecimiento vertical sobre el implante insertado es una técnica como hemos visto sencilla y predecible que nos permite ganar 1-2 mm necesarios para la colocación directa de un implante corto o extra-corto evitándonos cirugías regenerativas con mayor invasividad24,30-31. Estos procedimientos más complejos presentan una tasa de complicaciones a tener en cuenta: 6,8- 57,1% para la distracción osteogénica, 2,5-100% para los bloques óseos y 5,8-27,3% para la regeneración ósea guiada, según una reciente revisión sistemática con meta-análisis elaborada por Sánez-Ravello y cols32. Los implantes cortos y extracortos por su parte, presentan una menor morbilidad y tasas de éxito muy elevadas, con un tiempo de recuperación para el paciente mucho más corta si lo comparamos con los procedimientos de aumento óseo. Actualmente, 34 revisiones sistemáticas y metaanálisis de la base de datos PROSPERO sugieren que los implantes cortos pueden ser más predecibles que las técnicas de aumento óseo32-35. Existen diferentes procedimientos descritos en la literatura internacional para lograr crecimiento vertical sobre un implante colocado ligeramente supracrestal. Con este fin, se han empleado diferentes membranas no permeables y no reabsorbibles colocadas simultáneamente sin utilizar hueso autólogo, actuando únicamente como compartimento estanco (base de la regeneración ósea guiada)36-40. Otros trabajos que emplean barreras reforzadas con titanio y un coágulo sanguíneo también han logrado el crecimiento vertical del hueso, con una ganancia media de aproximadamente 2-3 mm38-39. El inconveniente de este tipo de membranas es que precisan una posterior retirada del material de osteosíntesis y tienen una mayor probabilidad de exposición en la fase de integración del implante y del injerto, con la pérdida ósea que esto conlleva además de complicaciones de tipo infeccioso41-42. Para evitar este tipo de problemas asociados a los materiales no reabsorbibles se han propuesto técnicas de crecimiento vertical entorno a los implantes dentales utilizando otro tipo de materiales como las esponjas de colágeno reabsorbibles impregnadas en diferentes sustancias como la proteína morfogenética humana, cubiertas posteriormente por membranas de colágeno, lográndose incrementos de hasta 4 mm, aunque la mayoría de estos trabajos son invitro36,43.
Las superficies son un factor importante en el diseño de implantes dentales, tanto para favorecer la oseointegración como para poder generar crecimiento óseo sobre las mismas a modo de “andamiaje”40,44. Las propiedades de la superficie del material del implante afectan a la adsorción de proteínas, la interacción célula-superficie y el desarrollo de células/tejido en esta interfaz, todo lo cual es relevante para procedimientos como el descrito en este trabajo, donde es necesaria la neoformación ósea en íntimo contacto con el implante dental19,26-27,44. Gran parte de la investigación previa sobre aumento óseo vertical se llevó a cabo con superficies de implante mecanizadas que no eran capaces de soportar la fijación de hueso nuevo tan eficazmente como las superficies de implante rugosas de las que disponemos actualmente, que son en su mayoría osteoprotectoras y osteoconductoras)40,45-46. Un diseño correcto de la superficie del implante puede estabilizar el injerto particulado una vez colocado sobre la misma y puede ayudar a guiar la osteogénesis vertical40. En los implantes utilizados en el presente trabajo, con una superficie multirrugosa en la que además se integra una capa superficial de iones de calcio (UnicCa®- Biotechnology institute), se estimula la actividad celular añadiéndose al potencial osteoprotector y osteoconductor anteriormente citado la propiedad de la osteoinducción. Durante las fases iniciales, la liberación de iones de calcio desde la superficie del implante induce la adhesión y la activación plaquetaria con la consiguiente liberación de los factores de crecimiento intragranulares en ellas contenidos47-49. Este proceso permite generar un gradiente químico que provoca la atracción a la superficie del implante de las células mesenquimales y osteoprogenitoras26-27,49-50 y la estimulación de su actividad generadora de hueso.51-52 Si a este potencial de la superficie, añadimos además las propiedades del PRGF-Endoret donde se encuentra inmerso el injerto óseo autólogo particulado que se utiliza en los casos de este trabajo para el crecimiento vertical, se produce una activación plaquetaria que desencadena diferentes procesos que llevan a la conversión, mediada por la trombina endógena, del fibrinógeno en fibrina. Este proceso es esencial para la coagulación y fijación del injerto. De nuevo, si el proceso se induce desde la superficie del implante, la formación del coágulo lleva a la estabilización de todo el injerto y supone un estímulo bioquímico y biomecánico para el reclutamiento de más células osteogénicas a la zona. Además, la estructura tridimiensional de la fibrina con agregados plaquetarios es un microentorno osteoinductivo, fundamental para las fases proliferativas posteriores50-52.
El crecimiento vertical medio logrado del conjunto de los implantes estudiados en el presente trabajo ha sido de 1,37 mm (± 0,40), teniendo en cuenta que en todos los casos se ha logrado el volumen pretendido, incluso en algunos por encima del mismo. Además, la media de la pérdida ósea crestal de todos los implantes medida en mesial fue de 0,52 mm (± 0,25) y la media de la pérdida ósea crestal distal de 0,57 (± 0,28). Estos resultados son satisfactorios comparados con otros procedimientos de aumento vertical, sobre todo teniendo en cuenta el amplio seguimiento de este estudio. En otros procedimientos como la regeneración ósea guiada, se han reportado ganancias de entre 2 y 8 mm con una pérdida ósea marginal media en los implantes de las zonas aumentadas de entre 1,8 y 2,0 mm durante un seguimiento de 1 a 7 años8 . La tasa de supervivencia de los implantes dentales en las zonas aumentadas con regeneración ósea guiada se situó entre el 92,1-100% a lo largo de 1-7 años8 . Para la osteogénesis por distracción, la ganancia ósea vertical se sitúa entre 5 y 15 mm, pero con una pérdida ósea marginal media en los implantes de entre 1 y 1,4 mm durante un seguimiento de 1 a 5 años y una tasa de supervivencia de los implantes que osciló entre el 90% y el 100%, con una tasa de complicaciones de entre el 10 y el 75,7%8 . En el caso de los injertos óseos onlay, la ganancia media de altura vertical osciló entre 4,2 y 4,6 mm, con una pérdida ósea marginal media en los implantes de las zonas aumentadas entre 0 y 4,9 mm durante un seguimiento de 1 a 3 años. La tasa de supervivencia global de los implantes colocados en estas zonas osciló entre el 76% y el 100% en los estudios analizados8 . En nuestro caso, no ha existido ningún fracaso, reportándose una tasa de éxito del 100% para los implantes y para el procedimiento, con un amplio seguimiento de los pacientes, llegando incluso en alguno de ellos hasta los 20 años y debemos tener en cuenta que todos ellos han sido colocados en la mandíbula, en las zonas posteriores, con extrema atrofia en altura, que es una de las zonas donde los procedimientos regenerativos obtienen peores resultados6,9,19. Es muy importante reseñar que para la consecución de resultados reproducibles, una serie de factores deben mantenerse, como la secuencia de fresado, basada en el fresado biológico (conservadora con el lecho y que nos permite recolectar el hueso para el injerto posterior), la utilización de la fresa de corte frontal, que nos permite acercarnos al canal dentario sin compresión ni posibilidad de daño nervioso y el empleo de la superficie de los implantes adecuada, que favorezca la aposición del coágulo de sangre inicialmente y la integración del injerto posteriormente (UnicCa® – Biotechnology institute)24-30. El uso de los factores de crecimiento para mantener y vehiculizar el injerto es un punto clave también a la hora de realizar estos procedimientos puesto que la viabilidad celular de los osteoblastos aumenta, teniendo más posibilidades de lograr el objetivo marcado51. El uso además de una membrana de fibrina cubriendo la superficie del injerto hace las veces de membrana reabsorbible biológica simplificando la técnica y evitando el riesgo de exposición54,55.
CONCLUSIONES
El uso de los implantes cortos y extra-cortos en conjunción con el crecimiento vertical tal como se ha descrito en la presente serie de casos es una alternativa segura y predecible en el momento y a lo largo del tiempo, como ha quedado demostrado con el seguimiento de los pacientes durante un mínimo de 10 años. La utilización de materiales como el hueso autólogo, una superficie bioactiva del implante y el uso de PRGF-Endoret, hacen que el injerto a integrar sea mucho más fácil de integrar y lograr los milímetros de crecimiento vertical necesario. Además, englobar el hueso particulado en PRGF-Endoret, hace que el material sea más sencillo de manejar. Utilizar implantes extra-cortos nos facilita la técnica al no necesitar generar un gran crecimiento alrededor del implante, ya que con un implante de 5,5 mm de longitud podemos lograr un comportamiento biomecánico igual que un implante de 7,5 y 8,5 mm, prescindiendo de este modo de técnicas más complejas.
REFERENCIAS
1. Elgali I, Omar O, Dahlin C, Thomsen P. Guided bone regeneration: materials and biological mechanisms revisited. Eur J Oral Sci. 2017 Oct;125(5):315-37.
2. Dragan E, Nemtoi A. Review of the Long-Term Outcomes of Guided Bone Regeneration and Autologous Bone Block Augmentation for Vertical Dental Restoration of Dental Implants. Med Sci Monit. 2022 Oct 18;28:e937433.
3. Urban I, Montero E, Sanz-Sánchez I, Palombo D, Monje A, Tommasato G, Chiapasco M. Minimal invasiveness in vertical ridge augmentation. Periodontol 2000. 2023 Feb;91(1):126-44.
4. Jepsen S, Schwarz F, Cordaro L, Derks J, Hämmerle CHF, Heitz-Mayfield LJ, Hernández-Alfaro F, Meijer HJA, Naenni N, Ortiz-Vigón A, Pjetursson B, Raghoebar GM, Renvert S, Rocchietta I, Roccuzzo M, Sanz-Sánchez I, Simion M, Tomasi C, Trombelli L, Urban I. Regeneration of alveolar ridge defects. Consensus report of group 4 of the 15th European Workshop on Periodontology on Bone Regeneration. J Clin Periodontol. 2019 Jun;46 Suppl 21:277-86.
5. Ra G, Wo Q. Bone regeneration in dentistry: an overview. J Biol Regul Homeost Agents. 2021 Jan-Feb;35 (1 Suppl. 1): 37-46.
6. Buser D, Brägger U, Lang NP, Nyman S. Regeneration and enlargement of jaw bone using guided tissue regeneration. Clin Oral Implants Res. 1990 Dec;1(1):22-32.
7. Abayev B, Juodzbalys G. Inferior Alveolar Nerve Lateralization and Transposition for Dental Implant Placement. Part II: a Systematic Review of Neurosensory Complications. J Oral Maxillofac Res. 2015 Mar 30;6(1):e3.
8. Tonetti MS, Hämmerle CH; European Workshop on Periodontology Group C. Advances in bone augmentation to enable dental implant placement: Consensus Report of the Sixth European Workshop on Periodontology. J Clin Periodontol. 2008 Sep;35(8 Suppl):168-72.
9. Esposito M, Grusovin MG, Rees J, Karasoulos D, Felice P, Alissa R, Worthington HV, Coulthard P. Interventions for replacing missing teeth: augmentation procedures of the maxillary sinus. Cochrane Database Syst Rev. 2010 Mar 17;(3):CD008397.
10. Anitua E, Anitua B, Alkhraisat MH, Piñas L, Torre A, Eguia A. Dental Implants Survival After Nasal Floor Elevation: A Systematic Review. J Oral Implantol. 2022 Dec 1;48(6):595-603.
11. Tutak M, Smektala T, Schneider K, Golebiewska E, Sporniak-Tutak K. Short dental implants in reduced alveolar bone height: a review of the literature. Med Sci Monit. 2013 Nov 21;19:1037-42.
12. Barausse C, Ravidà A, Bonifazi L, Pistilli R, Saleh MHA, Gasparro R, Sammartino G, Wang HL, Felice P. Extrashort (4-mm) implants placed after regenerative failures in the posterior atrophic mandible: A retrospective study. Int J Oral Implantol (Berl). 2023 Mar 2;16(1):31-8.
13. Srinivasan M, Vazquez L, Rieder P, Moraguez O, Bernard JP, Belser UC. Efficacy and predictability of short dental implants (<8 mm): a critical appraisal of the recent literature. Int J Oral Maxillofac Implants. 2012;27:1429–37.
14. Rossi F, Botticelli D, Cesaretti G, De Santis E, Storelli S, Lang NP. Use of short implants (6 mm) in a single-tooth replacement: a 5-year follow-up prospective randomized controlled clinical study. Clin Oral Implants Res. 2016;27:458–64.
15. Gulje F, Abrahamsson I, Chen S, Stanford C, Zadeh H, Palmer R. Implants of 6 mm vs. 11 mm lengths in the posterior maxilla and mandible: a 1-year multicenter randomized controlled trial. Clin Oral Implants Res. 2013;24:1325–31.
16. Esposito M, Pistilli R, Barausse C, Felice P. Three-year results from a randomized controlled trial comparing prostheses supported by 5-mm long implants or by longer implants in augmented bone in posterior atrophic edentulous jaws. Eur J Oral Implantol. 2014;7:383–95.
17. Moy PK, Aghaloo T. Risk factors in bone augmentation procedures. Periodontol 2000. 2019 Oct;81(1):76-90.
18. Bitinas D, Bardijevskyt G. Short implants without bone augmentation vs. long implants with bone augmentation: systematic review and meta-analysis. Aust Dent J. 2021 Mar;66 Suppl 1:S71-S81.
19. Anitua E, Murias-Freijo A, Alkhraisat MH, Orive G. ImplantGuided Vertical Bone Augmentation Around Extra-Short Implants for the Management of Severe Bone Atrophy. J Oral Implantol. 2015 Oct;41(5):563-9.
20. Anitua E, Troya M, Zalduendo M, Flores J, Tierno R, Alkhraisat MH. The influence of alveolar bone healing degree on its potential as a source of human alveolar bone-derived cells. Ann Anat. 2020 Nov;232:151578.
21. Anitua E, Alkhraisat MH, Piñas L, Orive G. Efficacy of biologically guided implant site preparation to obtain adequate primary implant stability. Ann Anat. 2015 May;199:9-15.
22. Anitua E, Carda C, Andia I. A novel drilling procedure and subsequent bone autograft preparation: a technical note. Int J Oral Maxillofac Implants. 2007 Jan-Feb;22(1):138-45. Erratum in: Int J Oral Maxillofac Implants. 2007 MarApr;22(2):309.
23. Anitua E, Alkhraisat MH. 15-year follow-up of short dental implants placed in the partially edentulous patient: Mandible Vs maxilla. Ann Anat. 2019 Mar;222:88-93.
24. Anitua E, Eguia A, Alkhraisat MH. Extra-short implants (≤6.5 mm in length) in atrophic and non-atrophic sites to support screw-retained full-arch restoration: a retrospective clinical study. Int J Implant Dent. 2023 Sep 13;9(1):29.
25. Anitua E, Orive G, Aguirre JJ, Andía I. Five-year clinical evaluation of short dental implants placed in posterior areas: a retrospective study. J Periodontol. 2008 Jan;79(1):42-8.
26. Anitua E, Tejero R. Coarse Surface Microcavities Permit Bone Ingrowth and Improve Implant Osseointegration. Int J Oral Maxillofac Implants. 2022 MarApr;37(2):289-301.
27. Anitua E, Tejero R. Provisional Matrix Formation at Implant Surfaces-The Bridging Role of Calcium Ions. Cells. 2022 Sep 29;11(19):3048.
28. Anitua E, Andia I, Ardanza B, Nurden P, Nurden AT. Autologous platelets as a source of proteins for healing and tissue regeneration. Thromb Haemost. 2004 Jan;91(1):4-15.
29. Romero Gavilán F, Cerqueira A, Anitua E, Muñoz F, García Arnáez I, Azkargorta M, Elortza F, Gurruchaga M, Goñi I, uay J, Tejero R. Enhancing the correlation between in vitro and in vivo experiments in dental implant osseointegration: investigating the role of Caions. J Mater Chem B. 2024 Mar 13;12(11):2831-42.
30. Anitua E, Alkhraisat MH, Piñas L, Orive G. Efficacy of biologically guided implant site preparation to obtain adequate primary implant stability. Ann Anat. 2015 May;199:9-15.
31. Nkenke E, Neukam FW. Autogenous bone harvesting and grafting in advanced jaw resorption: morbidity, resorption and implant survival. Eur J Oral Implantol. 2014 Summer;7 Suppl 2:S203-17.
32. Sáenz-Ravello G, Ossandón-Zúñiga B, Muñoz-Meza V, Mora-Ferraro D, Baeza M, Fan S, Sagheb K, Schiegnitz E, Díaz L. Short implants compared to regular dental implants after bone augmentation in the atrophic posterior mandible: umbrella review and meta-analysis of success outcomes. Int J Implant Dent. 2023 Jul 4;9(1):18.
33. Heitz-Mayfield LJ, Aaboe M, Araujo M, Carrion JB, Cavalcanti R, Cionca N, et al. Group 4 ITI consensus report: risks and biologic complications associated with implant dentistry. Clin Oral Implants Res. 2018;29 (Suppl 16):351–8.
34. Jung RE, Al-Nawas B, Araujo M, Avila-Ortiz G, Barter S, Brodala N, et al. Group 1 ITI consensus report: the influence of implant length and design and medications on clinical and patient-reported outcomes. Clin Oral Implants Res. 2018;29(Suppl 16):69–77.
35. Merli M, Moscatelli M, Pagliaro U, Mariotti G, Merli I, Nieri M. Implant prosthetic rehabilitation in partially edentulous patients with bone atrophy. An umbrella review based on systematic reviews of randomised controlled trials. Eur J Oral Implantol. 2018;11(3):261–80.
36. Simion, M., Trisi, P. & Piattelli, A. (1994) Vertical ridge augmentation using a membrane technique associated with osseointegrated implants. International Journal of Periodontics & Restorative Dentistry 14: 497–511.
37. Tinti, C., Parma-Benfenati, S. & Polizzi, G. (1996) Vertical ridge augmentation: what is the limit? International Journal of Periodontics & Restorative Dentistry 16: 221–9.
38. Jovanovic, S., Schenk, R., Orsini, M. & Kenney, E. (1995) Supracrestal bone formation around dental implants: an experimental dog study. International Journal of Oral & Maxillofacial Implants 10: 23–31.
39. Renvert, S., Claffey, N., Orafi, H.&Albrektsson, T.(1996) Supracrestal bone growth around partially inserted titanium implants in dogs. Clinical Oral Implants Research 7: 360–5.
40. Freilich M, Shafer D, Wei M, Kompalli R, Adams D, Kuhn L. Implant system for guiding a new layer of bone. Computed microtomography and histomorphometric analysis in the rabbit mandible. Clin Oral Implants Res. 2009 Feb;20(2):201-7.
41. Urban IA, Saleh MHA, Ravidà A, Forster A, Wang HL, Barath Z. Vertical bone augmentation utilizing a titaniumreinforced PTFE mesh: A multi-variate analysis of influencing factors. Clin Oral Implants Res. 2021 Jul;32(7):828-39.
42. Cunha G, Carvalho PHA, Quirino LC, Torres LHS, Filho VAP, Gabrielli MFR, Gabrielli MAC. Titanium Mesh Exposure After Bone Grafting: Treatment Approaches-A Systematic Review. Craniomaxillofac Trauma Reconstr. 2022 Dec;15(4):397-405.
43. Sigurdsson, T., Fu, E., Tatakis, D., Rohrer, M. & Wikesjo, U. (1997) Bonemorphogenetic protein-2 for peri-implant bone regeneration and osseointegration. Clinical Oral Implants Research 8: 367–74
44. Ratner, B. (1996) Biomedical Science: An Introduction to Materials in Medicine. San Diego, CA: Academic Press.
45. Martin, J., Schwartz, Z., Hummert, T., Schraub, D.,Simpson, J., Lankford, J. Jr, Dean, D., Cochran, D.& Boyan, B. (1995) Effect of titaniumsurface roughness on proliferation, differentiation, and protein synthesis of human osteoblastlike cells MG63. Journal of Biomedical Materials Research 29: 389.
46. Cochran, D., Nimmikoski, P., Higginbottom, F., Hermann, J., Makins, S. & Buser, D. (1996) Evaluation of an endosseous titanium implant with a sandblasted and acidetched surface in the canine mandible: radiographic results. Clinical Oral Implants Research 7: 240–52.
47. Woulfe DS. Platelet G protein-coupled receptors in hemostasis and thrombosis. J Thromb Haemost. 2005; 3: 2193-200.
48. Gupta S, Reviakine I. Platelet activation profiles on TiO2: effect of Ca2+ binding to the surface. Biointerphases. 2012; 7: 28-40.
49. Tejero R, Rossbach P, Keller B, Anitua E, Reviakine I. Timeof-Flight Secondary Ion Mass Spectrometry with principal component analysis of titania−blood plasma interfaces. Langmuir. 2013; 29: 902-12.
50. Anitua E, Prado R, Orive G, Tejero R. Effects of calciummodified titanium implant surfaces on platelet activation, clot formation, and osseointegration. J Biomed Mater Res A. 2015; 103: 969-80.
51. Anitua E, Sánchez M, Orive G, Andia I. Delivering growth factors for therapeutics. Trends Pharmacol Sci. 2008 Jan;29(1):37-41.
52. Anitua E, Tejero R. Provisional Matrix Formation at Implant Surfaces-The Bridging Role of Calcium Ions. Cells. 2022 Sep 29;11(19):3048.
53. Anitua E, Sánchez M, Orive G, Andía I. The potential impact of the preparation rich in growth factors (PRGF) in different medical fields. Biomaterials. 2007 Nov;28(31):4551-60.
54. Anitua E, Orive G, Pla R, Roman P, Serrano V, Andía I. The effects of PRGF on bone regeneration and on titanium implant osseointegration in goats: a histologic and histomorphometric study. J Biomed Mater Res A. 2009 Oct;91(1):158-65.
55. Anitua E. The use of plasma-rich growth factors (PRGF) in oral surgery. Pract Proced Aesthet Dent. 2001 Aug;13(6):487-93; quiz 487-93.













